
Aldehydenstructuur, eigenschappen, toepassingen en voorbeelden

De aldehyden het zijn organische verbindingen met de algemene formule RCHO. R staat voor een alifatische of aromatische keten; C tot koolstof; O naar zuurstof en H naar waterstof. Ze worden gekenmerkt door een carbonylgroep zoals ketonen en carbonzuren, daarom worden aldehyden ook wel carbonylverbindingen genoemd.
De carbonylgroep geeft het aldehyde veel van zijn eigenschappen. Het zijn verbindingen die gemakkelijk worden geoxideerd en zeer reactief zijn op nucleofiele toevoegingen. De dubbele binding van de carbonylgroep (C = O) heeft twee atomen die verschillen hebben in hun hebzucht naar elektronen (elektronegativiteit).
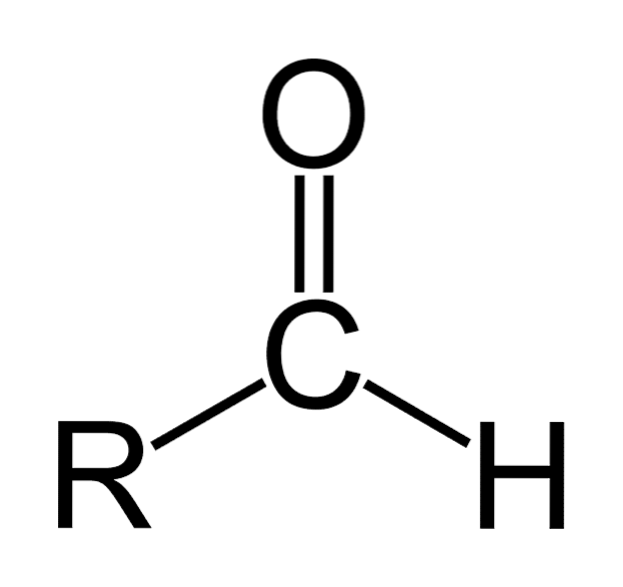
Zuurstof trekt elektronen met een grotere kracht aan dan koolstof, dus de elektronenwolk beweegt ernaartoe, waardoor de dubbele binding tussen koolstof en zuurstof polair van aard is, met een significant dipoolmoment. Dit maakt aldehyden polaire verbindingen..
De polariteit van de aldehyden zal hun fysische eigenschappen beïnvloeden. Het kookpunt en de oplosbaarheid van aldehyden in water zijn hoger dan niet-polaire chemische verbindingen met vergelijkbare molecuulgewichten, zoals het geval is bij koolwaterstoffen..
Aldehyden met minder dan vijf koolstofatomen zijn oplosbaar in water, aangezien waterstofbruggen worden gevormd tussen de zuurstof van de carbonylgroep en het watermolecuul. Het verhogen van het aantal koolstofatomen in de koolwaterstofketen produceert echter een toename van het niet-polaire deel van het aldehyde, waardoor het minder oplosbaar wordt in water..
Maar hoe zijn ze en waar komen ze vandaan? Hoewel de aard ervan in wezen afhangt van de carbonylgroep, draagt de rest van de moleculaire structuur ook veel bij aan het geheel. Ze kunnen dus van elke grootte zijn, klein of groot, of zelfs een macromolecuul kan gebieden hebben waar het karakter van aldehyden overheerst..
Dus, zoals bij alle chemische verbindingen, zijn er "aangename" aldehyden en andere bittere. Ze kunnen worden gevonden in natuurlijke bronnen of op grote schaal worden gesynthetiseerd. Voorbeelden van aldehyden zijn vanilline, zeer aanwezig in ijs (bovenste afbeelding), en aceetaldehyde, dat smaak toevoegt aan alcoholische dranken..
Artikel index
- 1 Chemische structuur
- 2 Fysische en chemische eigenschappen
- 2.1 Smeltpunten
- 2.2 Kookpunten
- 2.3 Oplosbaarheid in water uitgedrukt in g / 100 g H2O
- 3 Reactiviteit
- 3.1 Oxidatiereactie
- 3.2 Reductie tot alcoholen
- 3.3 Reductie tot koolwaterstoffen
- 3.4 Nucleofiele toevoeging
- 4 Nomenclatuur
- 5 toepassingen
- 5.1 Formaldehyde
- 5.2 Bakeliet
- 5.3 Multiplex
- 5.4 Polyurethaan
- 5.5 Butyraldehyde
- 5.6 Acetaldehyde
- 5.7 Synthese
- 6 Voorbeelden van aldehyden
- 6.1 Glutaaraldehyde
- 6.2 Benzaldehyde
- 6.3 Glyceraldehyde
- 6.4 Glyceraldehyde-3-fosfaat
- 6.5 11-cis-retinal
- 6.6 Pyridoxaalfosfaat (vitamine B6)
- 6.7 Salicylaldehyde
- 7 referenties
Chemische structuur

Aldehyden bestaan uit een carbonyl (C = O) waaraan direct een waterstofatoom is gehecht. Dit onderscheidt het van andere organische verbindingen zoals ketonen (R.tweeC = O) en carbonzuren (RCOOH).
De bovenste afbeelding toont de moleculaire structuur rond -CHO, een formylgroep. De formylgroep is vlak omdat koolstof en zuurstof sp-hybridisatie hebbentwee. Deze vlakheid maakt het vatbaar voor aanvallen door nucleofiele soorten en daarom wordt het gemakkelijk geoxideerd..
Waar verwijst deze oxidatie naar? Op de vorming van een binding met een ander atoom dat elektronegatiever is dan koolstof; en in het geval van aldehyden is het een zuurstof. Het aldehyde wordt dus geoxideerd tot een carbonzuur, -COOH. Wat als het aldehyde werd gereduceerd? In plaats daarvan zou een primaire alcohol worden gevormd, ROH.
Aldehyden worden alleen geproduceerd uit primaire alcoholen: die waarbij de OH-groep aan het einde van een keten zit. Evenzo de formylgroep voor altijd bevindt zich aan het einde van een ketting of steekt eruit of de ring als substituent (als er andere belangrijkere groepen zijn, zoals -COOH).
Fysische en chemische eigenschappen
Omdat het polaire verbindingen zijn, zijn hun smeltpunten hoger dan die van niet-polaire verbindingen. Aldehydemoleculen zijn niet in staat tot intermoleculaire binding via waterstofbruggen, omdat ze alleen koolstofatomen hebben die aan waterstofatomen zijn bevestigd..
Vanwege het bovenstaande hebben aldehyden lagere kookpunten dan alcoholen en carbonzuren.
Smeltpunten
Formaldehyde -92; Acetaldehyde -121; Propionaldehyde -81; n-Butyraldehyde -99; n-Valeraldehyde -91; Caproaldehyde -; Heptaldehyde - 42; Fenylacetaldehyde -; Benzaldehyde -26.
Kookpunten
Formaldehyde -21; Acetaldehyde 20; Propionaldehyde 49; n-Butyraldehyde 76; n-Valeraldehyde 103; Caproaldehyde 131; Heptaldehyde 155; Phenylacetaldehyde 194; Benzaldehyde 178.
Oplosbaarheid in water uitgedrukt in g / 100 g HtweeOF
Formaldehyde, zeer oplosbaar; Acetaldehyde, oneindig; Propionaldehyde, 16; n-Butyraldehyde, 7; n-Valeraldehyde, slecht oplosbaar; caproaldehyde, enigszins oplosbaar; Enigszins oplosbaar fenylacetaldehyde; Benzaldehyde, 0,3.
De kookpunten van aldehyden hebben de neiging direct toe te nemen met het molecuulgewicht. Integendeel, er is een tendens om de oplosbaarheid van aldehyden in water te verminderen naarmate hun molecuulgewicht toeneemt. Dit komt tot uiting in de fysische constanten van de zojuist genoemde aldehyden..
Reactiviteit
Oxidatiereactie
Aldehyden kunnen worden geoxideerd tot het overeenkomstige carbonzuur in aanwezigheid van een van deze verbindingen: Ag (NH3twee, KMnO4 OketweeCrtweeOF7.
Reductie tot alcoholen
Ze kunnen worden gehydrogeneerd met behulp van nikkel-, platina- of palladiumkatalysatoren. Dus de C = O wordt C-OH.
Reductie tot koolwaterstoffen
In aanwezigheid van Zn (Hg), geconcentreerd HCl of in NHtweeNHtwee aldehyden verliezen de carbonylgroep en worden koolwaterstoffen.
Nucleofiele toevoeging
Er zijn verschillende verbindingen die aan de carbonylgroep worden toegevoegd, waaronder: Grignard-reagentia, cyanide, derivaten van ammoniak en alcoholen.
Nomenclatuur
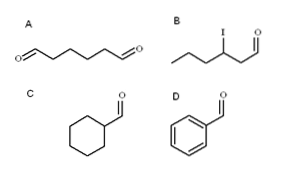
Vier aldehyden worden geïllustreerd in de bovenstaande afbeelding. Hoe heten ze??
Omdat het geoxideerde primaire alcoholen zijn, wordt de naam van de alcohol gewijzigd van -ol in -al. Dus methanol (CH3OH) indien geoxideerd tot CH3CHO heet methanal (formaldehyde); CH3CHtweeCHO ethanal (aceetaldehyde); CH3CHtweeCHtweeCHO propanal en CH3CHtweeCHtweeCHtweeCHO butanal.
Alle nieuw genoemde aldehyden hebben de -CHO-groep aan het einde van de keten. Als het aan beide uiteinden wordt gevonden, zoals in A, wordt het einde -al voorafgegaan door het voorvoegsel di-. Omdat A zes koolstofatomen heeft (die van beide formylgroepen meegerekend), is het afgeleid van 1-hexanol en is de naam daarom: hexaanwijzerplaat.
Als er een substituent is, zoals een alkylradicaal, een dubbele of drievoudige binding of een halogeen, worden de koolstofatomen van de hoofdketen vermeld, waarbij -CHO het nummer 1 geeft. Aldehyde B wordt dus genoemd: 3-joodhexanal.
In aldehyden C en D heeft de groep -CHO echter geen prioriteit om dergelijke verbindingen van anderen te identificeren. C is een cycloalkaan, terwijl D een benzeen is, beide met een van hun H's gesubstitueerd door een formylgroep.
In hen, omdat de hoofdstructuur cyclisch is, wordt de formylgroep carbaldehyde genoemd. C is dus cyclohexaancarbaldehyde en D is benzeencarbaldehyde (beter bekend als benzaldehyde).
Toepassingen
In de natuur bestaan aldehyden die aangename smaken kunnen afgeven, zoals het geval is bij kaneelaldehyde, dat verantwoordelijk is voor de karakteristieke smaak van kaneel. Daarom worden ze vaak als kunstmatige smaakstof gebruikt in veel producten zoals snoep of eten..
Formaldehyde
Formaldehyde is het industrieel meest geproduceerde aldehyde. Het formaldehyde dat wordt verkregen door de oxidatie van methanol wordt gebruikt in een 37% -oplossing van het gas in water, onder de naam formaline. Dit wordt gebruikt bij het looien van huiden en bij het conserveren en balsemen van lijken..
Evenzo wordt formaldehyde gebruikt als germicide, fungicide en insecticide voor planten en groenten. Het grootste nut ervan is echter de bijdrage aan de productie van polymeer materiaal. Het plastic genaamd bakeliet wordt gesynthetiseerd door de reactie tussen formaldehyde en fenol.
Bakeliet
Bakeliet is een zeer hard polymeer met een driedimensionale structuur dat wordt gebruikt in veel huishoudelijke artikelen zoals handvatten voor potten, pannen, koffiezetapparaten, messen, enz..
Bakelietachtige polymeren worden gemaakt van formaldehyde in combinatie met de verbindingen ureum en melamine. Deze polymeren worden niet alleen als kunststoffen gebruikt, maar ook als lijm- en coatingmateriaal..
Multiplex
Het triplex is de commerciële naam van een materiaal gevormd door dunne platen hout, verbonden door polymeren gemaakt van formaldehyde. De merken Formica en Melmac worden vervaardigd met medewerking van laatstgenoemde. Formica is een plastic materiaal dat wordt gebruikt in meubelbekleding.
Van Melmac-plastic worden borden, glazen, kopjes etc. gemaakt. Formaldehyde is de grondstof voor de synthese van de verbinding methyleen-difenyldiisocyanaat (MDI), een voorloper van polyurethaan.
Polyurethaan
Polyurethaan wordt gebruikt als isolator in koelkasten en diepvriezers, vulling voor meubels, matrassen, coatings, lijmen, zolen, enz..
Butyraldehyde
Butyraldehyde is de belangrijkste precursor voor de synthese van 2-ethylhexanol, dat wordt gebruikt als weekmaker. Het heeft een aangenaam appelaroma waardoor het als smaakstof in voedsel kan worden gebruikt.
Het wordt ook gebruikt voor de productie van rubberversnellers. Intervenieert als tussenproduct bij de bereiding van oplosmiddelen.
Acetaldehyde
Acetaldehyde werd gebruikt bij de productie van azijnzuur. Maar deze rol van aceetaldehyde is in belang afgenomen, omdat het is verdrongen door het carbonyleringsproces van methanol..
Synthese
Andere aldehyden zijn voorlopers van oxoalcoholen, die worden gebruikt bij de productie van wasmiddelen. Zogenaamde oxoalcoholen worden bereid door koolmonoxide en waterstof toe te voegen aan een olefine om een aldehyde te verkrijgen. En tot slot wordt het aldehyde gehydrogeneerd om de alcohol te verkrijgen.
Sommige aldehyden worden gebruikt bij de vervaardiging van parfums, zoals het geval is bij Chanel nr. 5. Veel aldehyden van natuurlijke oorsprong hebben een aangename geur, bijvoorbeeld: heptanal heeft een groene grasgeur; de octanal een sinaasappelgeur; de nonanal een geur van rozen en de citral een geur van limoen.
Voorbeelden van aldehyden
Glutaaraldehyde
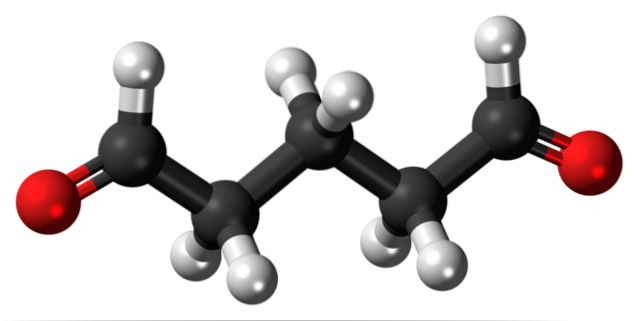
Glutaaraldehyde heeft aan beide uiteinden twee formylgroepen in zijn structuur.
Op de markt gebracht onder de naam Cidex of Glutaral, wordt het gebruikt als ontsmettingsmiddel om chirurgische instrumenten te steriliseren. Het wordt gebruikt om wratten op de voeten te behandelen door het als een vloeistof aan te brengen. Het wordt ook gebruikt als weefselfixerend middel in histologische en pathologielaboratoria..
Benzaldehyde
Het is het eenvoudigste aromatische aldehyde dat wordt gevormd door een benzeenring waaraan een formylgroep is gekoppeld.
Het wordt aangetroffen in amandelolie, vandaar de karakteristieke geur waardoor het als voedselaroma kan worden gebruikt. Bovendien wordt het gebruikt bij de synthese van organische verbindingen die verband houden met de vervaardiging van geneesmiddelen en bij de vervaardiging van kunststoffen..
Glyceraldehyde
Het is een aldotriose, een suiker die uit drie koolstofatomen bestaat. Het heeft twee isomeren, de enantiomeren D en L. Glyceraldehyde is het eerste monosaccharide dat wordt verkregen bij fotosynthese tijdens de donkere fase (Calvin-cyclus)..
Glyceraldehyde-3-fosfaat
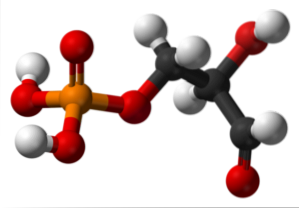
De bovenste afbeelding illustreert de structuur van glyceraldehyde-3-fosfaat. De rode bollen naast de gele komen overeen met de fosfaatgroep, de zwarte met het koolstofskelet. De rode bol die aan de witte is gekoppeld, is de OH-groep, maar wanneer deze is gekoppeld aan de zwarte bol en de laatste aan de witte, dan is het de CHO-groep..
Glyceraldehyde-3-fosfaat is betrokken bij glycolyse, een metabolisch proces waarbij glucose wordt afgebroken tot pyrodruivenzuur met de productie van ATP, een energiereservoir van levende wezens. Naast de productie van NADH, een biologisch reductiemiddel.
Bij glycolyse zijn glyceraldehyde-3-fosfaat en dihydroacetonfosfaat afkomstig van de splitsing van D-fructose-1-6-bisfosfaat
Glyceraldehyde-3-fosfaat is betrokken bij het metabolische proces dat bekend staat als de pentosecyclus. Daarin wordt NADPH, een belangrijke biologische reductor, gegenereerd..
11-cis-retinal
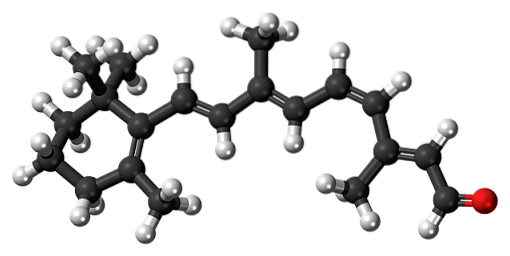
Β-caroteen is een natuurlijk pigment dat aanwezig is in verschillende groenten, vooral in wortelen. Het ondergaat een oxidatieve afbraak in de lever en verandert zo in retinolalcohol of vitamine A. De oxidatie van vitamine A en de daaropvolgende isomerisatie van een van zijn dubbele bindingen, vormt het 11-cis-retinale aldehyde..
Pyridoxaalfosfaat (vitamine B6)
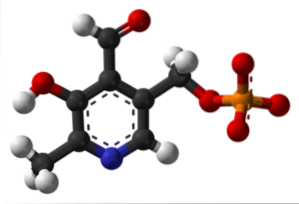
Het is een prothetische groep die is gekoppeld aan verschillende enzymen, de actieve vorm van vitamine B6 en die deelneemt aan het syntheseproces van de remmende neurotransmitter GABA..
Waar is de formylgroep in uw structuur? Merk op dat dit verschilt van de rest van de groepen die aan de aromatische ring zijn gekoppeld.
Salicylaldehyde
Het is een grondstof voor de synthese van acetylsalicylzuur, een analgeticum en koortswerend middel dat bekend staat als aspirine..
Referenties
- Robert C. Neuman, Jr. Hoofdstuk 13, Carbonylverbindingen: ketonen, aldehyden, carbonzuren. [Pdf]. Genomen uit: chem.ucr.edu
- Germán Fernández. (14 september 2009). Nomenclatuur van aldehyden. Genomen uit: quimicaorganica.net
- T.W. Graham Solomons, Craigh B. Fryhle. Organische chemie. (Tiende editie, p. 729-731) Wiley Plus.
- Jerry March en William H. Brown. (31 december 2015). Aldehyde. Genomen uit: britannica.com
- Wikipedia. (2018). Aldehyden. Genomen uit: https://en.wikipedia.org/wiki/Aldehyde
- Morrison, R. T. en Boyd, R. N. (1990). Organic Chemistry, vijfde editie. Redactioneel Addison-Wesley Iberoamericana.
- Carey, F. A. (2006). Organische chemie zesde editie. Mc Graw Hill Publishing House.
- Mathews, Ch. K., Van Holde, K. E. en Athern, K. G. (2002). Biochemie. Derde editie. Uitgever Pearson Adisson Wesley.


Niemand heeft nog op dit artikel gereageerd.