
Allotropie Allotrope transformatie en hoofdelementen

De allotropie in de scheikunde is het het kenmerk dat bepaalde chemische elementen zichzelf in verschillende vormen presenteren, maar in dezelfde toestand van aggregatie van materie. De structuur van de elementen kan variëren afhankelijk van hun moleculaire rangschikking en de omstandigheden waarin ze worden gevormd, zoals druk en temperatuur..
Alleen als het om chemische elementen gaat, wordt het woord allotropie gebruikt, waarmee elk van de manieren wordt aangeduid waarop een element in dezelfde fase als een allotroop kan worden gevonden; dat het niet van toepassing is op verbindingen met verschillende kristallijne structuren; in dit geval wordt het polymorfisme genoemd.
Er zijn andere gevallen bekend, zoals die van zuurstof, waarin allotropie kan optreden als verandering in het aantal atomen van de stof. In die zin is er een idee van twee allotropen van dit element, die beter bekend staan als zuurstof (Otwee) en ozon (O3.
Artikel index
- 1 Allotrope transformatie
- 2 Belangrijkste allotrope elementen
- 2.1 Koolstof
- 2.2 Zwavel
- 2.3 Fosfor
- 2.4 Zuurstof
- 3 referenties
Allotrope transformatie
Zoals eerder vermeld, zijn allotropen de verschillende manieren waarop hetzelfde element kan worden gevonden, dus deze variatie in zijn structuur zorgt ervoor dat deze soorten verschijnen met verschillende fysische en chemische kenmerken..
Evenzo vindt de allotrope transformatie tussen het ene element en het andere plaats door de manier waarop de atomen in de moleculen zijn gerangschikt; dat wil zeggen, de manier waarop de link ontstaat.
Deze verandering tussen de ene allotroop en de andere kan om verschillende redenen plaatsvinden, zoals veranderingen in de omstandigheden van druk, temperatuur en zelfs de inval van elektromagnetische straling zoals licht..
Wanneer de structuur van een chemische soort wordt gewijzigd, kan het ook zijn gedrag veranderen, waarbij eigenschappen worden gewijzigd zoals zijn elektrische geleidbaarheid, hardheid (in het geval van vaste stoffen), smelt- of kookpunt en zelfs fysieke eigenschappen zoals de kleur..
Bovendien kan allotropie van twee soorten zijn:
- Monotroop, wanneer een van de elementstructuren onder alle omstandigheden een grotere stabiliteit heeft dan de andere.
- Enantropisch, wanneer de verschillende structuren stabiel zijn onder verschillende omstandigheden, maar op een omkeerbare manier in elkaar kunnen veranderen bij bepaalde drukken en temperaturen.
Belangrijkste allotrope elementen
Hoewel er meer dan honderd bekende elementen in het periodiek systeem zijn, hebben ze niet allemaal allotrope vormen. De meest bekende allotropen worden hieronder weergegeven.
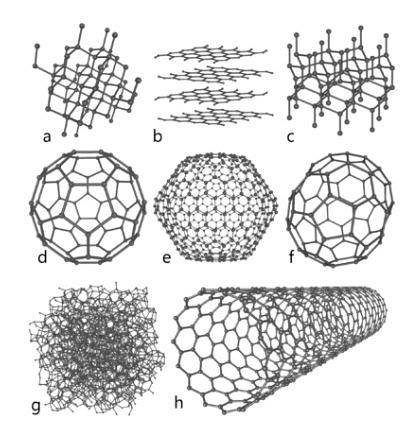
Koolstof
Dit element van grote overvloed in de natuur vertegenwoordigt de fundamentele basis van organische chemie. Er zijn verschillende allotrope soorten hiervan bekend, waaronder diamant, grafiet en andere die hieronder worden blootgesteld, opvallen..
Diamant
De diamant vertoont een moleculaire rangschikking in de vorm van tetraëdrische kristallen waarvan de atomen zijn verbonden door enkele bindingen; dit betekent dat ze zijn gerangschikt door hybridisatie sp3.
Grafiet
Grafiet bestaat uit opeenvolgende koolstofplaten, waarvan de atomen door dubbele bindingen in hexagonale structuren zijn verbonden; dat wil zeggen met hybridisatie sptwee.
Carbino
Naast de twee belangrijke allotropen die hierboven zijn genoemd, die de bekendste zijn van koolstof, zijn er andere, zoals carbyne (zoals lineaire acetyleenkoolstof, LAC, ook bekend is), waar de atomen ervan lineair zijn gerangschikt via drievoudige bindingen; dat wil zeggen met hybridisatie sp.
Anderen
- Grafeen, waarvan de structuur sterk lijkt op grafiet).
- Fullereen of buckminsterfullereen, ook bekend als buckyball, waarvan de structuur zeshoekig is, maar de atomen zijn gerangschikt in de vorm van een ring.
- Koolstof nanobuisjes, cilindrisch van vorm.
- Amorfe koolstof, zonder kristallijne structuur.
Zwavel
Zwavel heeft ook verschillende allotropen die als algemeen worden beschouwd, zoals de volgende (opgemerkt moet worden dat deze allemaal in vaste toestand zijn):
Rhombische zwavel
Zoals de naam al aangeeft, bestaat de kristallijne structuur uit achthoekige ruiten en staat ook bekend als α-zwavel..
Monokliene zwavel
Bekend als β-zwavel, heeft het de vorm van een prisma dat bestaat uit acht zwavelatomen.
Gesmolten zwavel
Het produceert prismatische kristallen die bij bepaalde temperaturen stabiel zijn en naalden zonder kleur vormen..
Plastic zwavel
Ook wel zwavel genoemd, het heeft een amorfe structuur.
Vloeibare zwavel
Het heeft viscositeitskenmerken in tegenstelling tot de meeste elementen, omdat het in deze allotroop groeit met toenemende temperatuur.
Bij elkaar passen
Dit niet-metalen element wordt vaak in de natuur aangetroffen in combinatie met andere elementen en heeft verschillende bijbehorende allotrope stoffen:
Witte fosfor
Het is een vaste stof met een tetraëdrische kristallijne structuur en heeft toepassingen op militair gebied, zelfs als chemisch wapen..
Zwarte fosfor
Het heeft de hoogste stabiliteit onder de allotropen van dit element en lijkt sterk op grafeen.
Rode fosfor
Vormt een amorfe vaste stof met reducerende eigenschappen maar heeft geen toxiciteit.
Difosfor
Zoals de naam aangeeft, bestaat het uit twee fosforatomen en is het een gasvormige vorm van dit element.
Violette fosfor
Het is een vaste stof met een kristallijne structuur met een monokliene moleculaire rangschikking..
Scharlaken fosfor
Ook solide amorfe structuur.
Zuurstof
Ondanks dat het een van de meest voorkomende elementen in de atmosfeer van de aarde is en een van de meest voorkomende elementen in het universum, heeft het weinig bekende allotropen, waaronder dizuurstof en trioxygen..
Dizuurstof
Dizuurstof is beter bekend onder de eenvoudige naam zuurstof, een gasvormige stof die essentieel is voor de biologische processen van deze planeet..
Trioxygen
Trioxygen is beter bekend als ozon, een zeer reactieve allotroop waarvan de bekendste functie is om de atmosfeer van de aarde te beschermen tegen externe stralingsbronnen..
Tetraoxygen
Vormt een vaste fase van trigonale structuur met kenmerken van metastabiliteit.
Anderen
Er zijn ook zes andere vaste soorten die zuurstof vormt, met verschillende kristallijne structuren..
Evenzo zijn er elementen zoals onder andere selenium, boor, silicium die verschillende allotropen vertonen en die met een min of meer diepte zijn bestudeerd..
Referenties
- Wikipedia. (s.f.). Allotropie. Opgehaald van en.wikipedia.org
- Chang, R. (2007). Chemistry, negende editie. Mexico: McGraw-Hill.
- Britannica, E. (s.f.). Allotropie. Opgehaald van britannica.com
- ThoughtCo. (s.f.). Allotrope-definitie en voorbeelden. Opgehaald van thoughtco.com
- Ciach, R. (1998). Geavanceerde lichte legeringen en composieten. Opgehaald van books.google.co.ve



Niemand heeft nog op dit artikel gereageerd.