
Anionvorming, kenmerken en typen
EEN anion Het is elke chemische soort met een negatieve lading, naast dat het een van de twee soorten bestaande ionen is. De negatieve lading komt voort uit het feit dat het een teveel aan elektronen heeft in vergelijking met de neutrale vorm van de soort; voor elk extra elektron neemt de negatieve lading met één eenheid toe.
De negatieve lading kan zich in een of meer atomen bevinden, maar ook de invloed ervan op een molecuul als geheel. Eenvoudigheidshalve wordt, ongeacht waar de lading (-) is, de hele soort, verbinding of molecuul als een anion beschouwd..
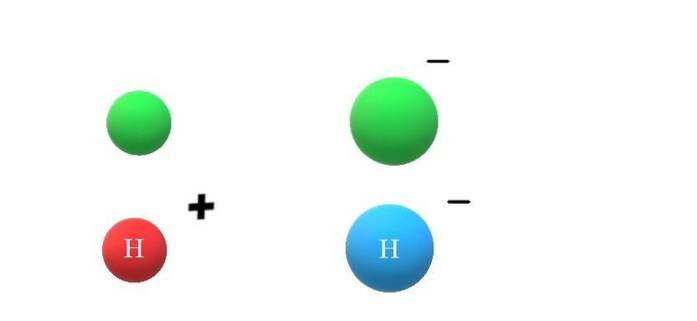
Als een neutrale soort X een elektron krijgt, zullen de overtollige negatieve ladingen zich manifesteren in de vorming van het anion X-, wat ook zal leiden tot een toename van de atoomstraal (bovenste afbeelding, met groene bollen). X en X- verschillen enorm in hun eigenschappen en in de manier waarop ze omgaan met hun omgeving.
Als men nu aanneemt dat X bijvoorbeeld het H-atoom is, kan daaruit een kation of anion ontstaan: H+ of H-, respectievelijk. Het kation H+ Het is het waterstofion, ook wel een proton genoemd; en de H- is het hydride-anion, de "eenvoudigste" van alle bekende anionen.
Artikel index
- 1 Vorming van een anion
- 1.1 Formele kosten en minder links
- 1.2 Kortingen
- 1.3 Fysica
- 2 kenmerken
- 3 soorten
- 3.1 Monatomisch
- 3.2 Oxoanionen
- 3.3 Biologisch
- 3.4 Polyatomisch
- 3.5 Moleculair of complex
- 4 referenties
Vorming van een anion
De vorming van een anion kan gemakkelijk binnen de theorie worden verklaard; Hoewel het experimenteel gezien een uitdaging kan zijn, vooral als je het puur wilt, zonder positieve ladingen die worden aangetrokken door de negatieve ladingen..
Formele aanklachten en minder links
Een anion zal zich vormen wanneer er een teveel of winst aan elektronen in een atoom is. Deze winst kan worden bepaald door gebruik te maken van de formele lasten in een Lewis-structuur. Ook kun je met de vorige methode precies weten van welk atoom of welke groep de negatieve lading afkomstig is.
Wanneer atomen covalente bindingen vormen, kan er, zelfs als de elektronenverdeling billijk is, een gedeeltelijk verlies van elektronen optreden. In die zin geldt: hoe minder bindingen, hoe meer elektronegatieve atomen zich vormen, hoe meer vrije elektronenparen ze zullen hebben en daarom negatieve ladingen vertonen..
Beschouw bijvoorbeeld het molecuul ammoniak, NH3. NH3 het is neutraal en heeft daarom geen elektrische ladingen. Als een H zou worden verwijderd, dat wil zeggen een NH-binding zou worden verbroken, zou het anion NH worden verkregentwee-. Dit kan worden geverifieerd door de Lewis-structuur te tekenen en de formele lading van N te berekenen.
Na het verbreken van meer NH-bindingen, hebben we nu het NH-aniontwee-en door de laatste H te elimineren, wordt uiteindelijk het anion N verkregen3-, genaamd nitride-anion. Stikstof heeft niet langer een manier om meer elektronen te winnen, en de lading van -3 is het meest negatief dat het kan bereiken; hun orbitalen geven niet voor meer.
Verlagingen
Een anion kan worden gevormd als gevolg van een reductie: het wint elektronen door een andere soort te oxideren, die ze verliest. Zuurstof vertegenwoordigt dit type chemische reactie bijvoorbeeld heel goed..
Wanneer zuurstof wordt verminderd, oxideert het tot een andere soort en wordt het het oxide-anion, Otwee-aanwezig in talloze mineralen en anorganische verbindingen.
Fysiek
Een atoom kan elektronen winnen als het zich in de gasfase bevindt:
X (g) + e- => X-(g)
Deze manier om een anion te vormen impliceert een brede kennis van fysische technieken, terwijl gasvormige anionen niet gemakkelijk te bestuderen zijn, noch zijn alle soorten gemakkelijk te verdampen of te vernevelen naar de gasfase..
Kenmerken
In algemene termen zullen de typische kenmerken van een anion hieronder worden vermeld voordat hun typen en voorbeelden worden besproken:
-Het is omvangrijker dan het neutrale atoom waarvan het is afgeleid.
-Het kan min of meer stabiel zijn, ondanks de toenemende elektronische afstoting tussen zijn eigen elektronen.
-Als het anion afkomstig is van een laag elektronegatief atoom, zoals koolstof, is het erg reactief.
-Zorg voor sterke dipoolmomenten.
-Verhoogt de interactie met polaire oplosmiddelen verder.
-Het mono-atomaire anion is iso-elektronisch voor het edelgas van zijn periode; dat wil zeggen, het heeft hetzelfde aantal elektronen in zijn valentieschil.
-Het kan de elektronenwolk van een naburig atoom polariseren en zijn buitenste elektronen afstoten.
Types
Monatomisch
Zoals de naam al doet vermoeden, is het een anion dat uit één atoom bestaat: de negatieve lading is goed gelokaliseerd. Elke groep op het periodiek systeem heeft karakteristieke negatieve ladingen; en omdat het anionen zijn, zijn het de niet-metalen die zich in het p-blok bevinden. Enkele voorbeelden en hun namen staan hieronder:
-Cl-, chloride.
-ik-, Ik laatste.
-F.-, fluoride.
-Br-, bromide.
-OFtwee-, oxyde.
-Stwee-, sulfide.
-ik weettwee-, selenide.
-Theetwee-, telluride.
-Potwee-, poloniur.
-N3-, nitride.
-P.3-, fosfide.
-Aas3-, arsenide.
-Sb3-, antimoniuro.
-C4-, hardmetaal.
-Ja4-, silicide.
-B3-, boruro.
Oxoanionen
Oxoanionen worden gekenmerkt doordat ze een X = O-binding hebben, waarbij X elk niet-metallisch element kan zijn (behalve fluor), of een metaal (chroom, mangaan, enz.). Ze kunnen ook een of meer eenvoudige X-O-koppelingen hebben.
Enkele oxoanionen met hun respectievelijke namen zijn:
-ClO-, hypochloriet.
-BrO-, hypobromiet.
-IO-, hypojodiet.
-ClOtwee-, chloriet.
-ClO3-, chloraat.
-IO3-, jodaat.
-ClO4-, perchloraat.
-PO43-, fosfaat.
-CO3twee-, carbonaat.
-CrO4twee-, chromaat.
-CrtweeOF7twee-, dichromaat.
-SW4twee-, sulfaat.
-StweeOF3twee-, thiosulfaat.
-NIET3-, nitraat.
-NIETtwee-, nitriet.
-BO33-, boraat.
-AsO43-, arsenaat.
-PO33-, fosfiet.
-MnO4-, permanganaat.
Biologisch
Organische moleculen hebben functionele groepen die elektrisch geladen kunnen worden. Hoe? Door de vorming of verbreking van covalente bindingen, vergelijkbaar met het voorbeeld van het NH-molecuul3.
Enkele organische anionen zijn:
-CH3COO-, acetaat.
-HCOO-, Formaat.
-CtweeOF4twee-, oxalaat.
-RCOO-, carboxylaat.
-CH3CONH-, amidaat.
-RO-, alkoxide.
-R3C-, carbanion.
-CH3OF-, methoxide.
Polyatomisch
Oxoanionen zijn ook polyatomaire anionen, dat wil zeggen dat ze uit meer dan één atoom bestaan. Hetzelfde gebeurt met organische anionen. Polyatomics vallen echter niet in een van de bovenstaande classificaties. Sommige ervan zijn:
-CN-, cyanide (heeft een drievoudige binding, C≡N).
-OCN-, cyanaat.
-SCN-, thiocyanaat.
-NHtwee-, Amide.
-Oh-, hydroxyl, hydroxide of hydroxyl.
-OFtwee-, superoxide.
-OFtweetwee-, peroxide.
Moleculair of complex
In organische anionen werden enkele negatief geladen functionele groepen genoemd. Deze groepen kunnen deel uitmaken van een groot molecuul, en dus kan het anion een hele robuuste verbinding zijn met veel bindingen. De eenvoudigste van dit type anionen is het hypothetische molecuul van H.twee-.
Een ander voorbeeld van deze anionen zijn polysulfiden, S.ntwee-, die bestaan uit kettingen met meerdere SS-bindingen. Ook negatief geladen metaalcoördinatieverbindingen zoals [CoCl4(NH3twee en [CuCl4twee-.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2019). Anion. Hersteld van: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (21 maart 2019). Lijst met gemeenschappelijke anionen en formules. Hersteld van: thoughtco.com
- Stichting CK-12. (2016, 29 juni). Anionvorming. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- Francis E. (2002). Anionen. Clackamas Community College. Hersteld van: dl.clackamas.edu
- American Physical Society. (3 november 2011). Synopsis: The Simplest Molecular Anion. Hersteld van: physics.aps.org



Niemand heeft nog op dit artikel gereageerd.