
Londen dwingt kenmerken en voorbeelden af
De Londense troepen, Londense verstrooiingskrachten, of geïnduceerde dipool-dipool-interacties, zijn het zwakste type intermoleculaire interacties. De naam is te danken aan de bijdragen van de natuurkundige Fritz London en zijn studies op het gebied van de kwantumfysica.
De krachten van Londen verklaren hoe moleculen met elkaar in wisselwerking staan, waarvan de structuren en atomen het hem onmogelijk maken een permanente dipool te vormen; dat wil zeggen, het is fundamenteel van toepassing op apolaire moleculen of geïsoleerde atomen van edelgassen. In tegenstelling tot de andere Van der Waals-krachten, vereist deze extreem korte afstanden.

Een goede fysieke analogie van de Londense strijdkrachten is te vinden in de werking van het klittenbandsluitingssysteem (afbeelding hierboven). Door de ene kant van de stof die met haken is geborduurd te drukken, en de andere met vezels, wordt een aantrekkingskracht gecreëerd die evenredig is met het oppervlak van de stoffen.
Zodra beide gezichten zijn verzegeld, moet een kracht worden uitgeoefend om hun interacties tegen te gaan (uitgevoerd door onze vingers) om ze van elkaar te scheiden. Hetzelfde geldt voor moleculen: hoe omvangrijker of platter ze zijn, hoe groter hun intermoleculaire interacties op zeer korte afstanden..
Het is echter niet altijd mogelijk om deze moleculen op een afstand te benaderen die dichtbij genoeg is om hun interacties merkbaar te maken..
Als dit het geval is, hebben ze zeer lage temperaturen of zeer hoge drukken nodig; als zodanig is het geval bij gassen. Evenzo kunnen dit soort interacties aanwezig zijn in vloeibare stoffen (zoals n-hexaan) en vaste stoffen (zoals jodium)..
Artikel index
- 1 Kenmerken
- 1.1 Homogene lastverdeling
- 1.2 Polariseerbaarheid
- 1.3 Het is omgekeerd evenredig met de afstand
- 1.4 Het is recht evenredig met de moleculaire massa
- 2 Voorbeelden van Londense troepen
- 2.1 In de natuur
- 2.2 Alkanen
- 2.3 Halogenen en gassen
- 3 referenties
Kenmerken
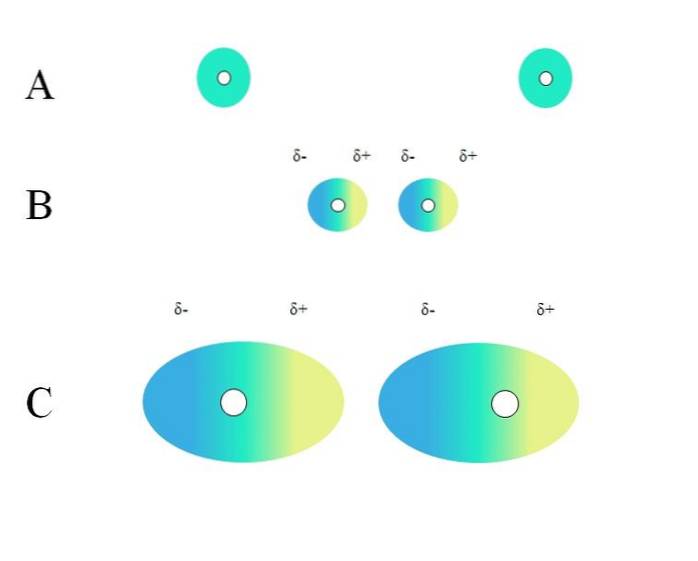
Welke kenmerken moet een molecuul hebben om te kunnen interageren met Londense krachten? Het antwoord is dat iedereen het zou kunnen doen, maar wanneer er een permanent dipoolmoment is, overheersen dipool-dipool-interacties meer dan verstrooiende interacties, die heel weinig bijdragen aan de fysieke aard van stoffen..
In structuren waar er geen sterk elektronegatieve atomen zijn of waarvan de elektrostatische ladingsverdeling homogeen is, is er geen extreem of gebied dat als rijk (δ-) of arm (δ +) aan elektronen kan worden beschouwd.
In deze gevallen moeten andere soorten krachten optreden, anders zouden deze verbindingen alleen in de gasfase kunnen bestaan, ongeacht de druk of temperatuur die erop werken..
Homogene lastverdeling
Twee geïsoleerde atomen, zoals neon of argon, hebben een homogene ladingsverdeling. Dit is te zien in A, bovenste afbeelding. De witte cirkels in het midden vertegenwoordigen de kernen, voor atomen, of het moleculaire skelet, voor moleculen. Deze ladingsverdeling kan worden beschouwd als een groene elektronenwolk.
Waarom voldoen edelgassen aan deze homogeniteit? Omdat ze hun elektronische omhulsel helemaal vol hebben, zouden hun elektronen theoretisch de aantrekkelijke lading van de kern in alle orbitalen evenveel moeten voelen..
Aan de andere kant, voor andere gassen, zoals atomaire zuurstof (O), is de schaal onvolledig (wat wordt waargenomen in de elektronische configuratie) en dwingt deze om het diatomische molecuul O te vormentwee om dit tekort te compenseren.
De groene cirkels in A kunnen ook moleculen zijn, klein of groot. Zijn elektronenwolk draait rond alle atomen waaruit het bestaat, vooral de meest elektronegatieve. Rondom deze atomen zal de wolk geconcentreerd zijn en negatiever zijn, terwijl andere atomen een elektronisch tekort zullen hebben.
Deze wolk is echter niet statisch maar dynamisch, dus op een gegeven moment zullen zich korte δ- en δ + -gebieden vormen, en een fenomeen genaamd Polarisatie.
Polariseerbaarheid
In A geeft de groene wolk een homogene verdeling van negatieve lading aan. De positieve aantrekkingskracht die door de kern wordt uitgeoefend, kan echter op de elektronen oscilleren. Dit veroorzaakt een vervorming van de wolk, waardoor gebieden δ-, in blauw en δ +, in geel ontstaan..
Dit plotselinge dipoolmoment in het atoom of molecuul kan een aangrenzende elektronenwolk vervormen; met andere woorden, het veroorzaakt een plotselinge dipool op zijn buurman (B, bovenste afbeelding).
Dit komt omdat het δ-gebied de naburige wolk verstoort, de elektronen voelen elektrostatische afstoting en zijn georiënteerd op de tegenoverliggende pool, waardoor ze δ verschijnen+.
Merk op hoe de positieve polen op één lijn liggen met de negatieve polen, net zoals moleculen met permanente dipoolmomenten dat doen. Hoe omvangrijker de elektronenwolk, des te moeilijker zal de kern hem homogeen in de ruimte houden; en ook, hoe groter de vervorming ervan, zoals te zien is in C.
Daarom is het minder waarschijnlijk dat atomen en kleine moleculen worden gepolariseerd door welk deeltje dan ook in hun omgeving. Een voorbeeld voor deze situatie wordt geïllustreerd door het kleine molecuul waterstof, Htwee.
Om te condenseren, of zelfs meer, om te kristalliseren, heeft het een buitensporige druk nodig om zijn moleculen te dwingen tot fysieke interactie.
Het is omgekeerd evenredig met de afstand
Hoewel ogenblikkelijke dipolen worden gevormd die anderen om hen heen induceren, zijn ze niet voldoende om de atomen of moleculen bij elkaar te houden..
In B is er een afstand d dat de twee wolken en hun twee kernen scheidt. Zodat beide dipolen gedurende een weloverwogen tijd kunnen blijven, deze afstand d het moet erg klein zijn.
Aan deze voorwaarde, een essentieel kenmerk van de Londense krachten (denk aan de klittenbandsluiting), moet worden voldaan om een merkbaar effect te hebben op de fysieke eigenschappen van de materie..
Een keer d klein is, zal de kern aan de linkerkant in B het blauwe δ-gebied van het naburige atoom of molecuul beginnen aan te trekken. Dit zal de wolk verder vervormen, zoals te zien is in C (de kern bevindt zich niet langer in het midden maar aan de rechterkant). Dan komt er een punt waarop beide wolken elkaar raken en "stuiteren", maar langzaam genoeg om ze een tijdje bij elkaar te houden..
Daarom zijn de Londense strijdkrachten omgekeerd evenredig met de afstand d. In feite is de factor gelijk aan d7, dus een kleine variatie in de afstand tussen de twee atomen of moleculen zal de Londense verstrooiing verzwakken of versterken.
Het is recht evenredig met de moleculaire massa
Hoe kunnen de wolken groter worden zodat ze gemakkelijker polariseren? Elektronen toevoegen, en daarvoor moet de kern meer protonen en neutronen hebben, waardoor de atoommassa toeneemt; of door atomen toe te voegen aan de ruggengraat van het molecuul, waardoor de molecuulmassa toeneemt
Op deze manier zouden de kernen of het moleculaire skelet de elektronenwolk niet altijd uniform houden. Daarom, hoe groter de groene cirkels die in A, B en C worden beschouwd, hoe meer polariseerbaar ze zullen zijn en hoe groter ook hun interacties door Londense troepen zullen zijn..
Dit effect wordt duidelijk waargenomen tussen B en C, en zou zelfs nog sterker kunnen zijn als de cirkels een grotere diameter zouden hebben. Deze redenering is de sleutel tot het verklaren van de fysische eigenschappen van veel verbindingen op basis van hun moleculaire massa..
Voorbeelden van Londense troepen

In de natuur
In het dagelijks leven zijn er talloze voorbeelden van de verspreidingskrachten van Londen zonder überhaupt in de microscopisch kleine wereld te duiken..
Een van de meest voorkomende en verrassende voorbeelden is te vinden in de poten van reptielen die gekko's worden genoemd (bovenste afbeelding) en bij veel insecten (ook in Spiderman).
Op hun benen hebben ze kussentjes waaruit duizenden kleine filamenten uitsteken. Op de afbeelding zie je een gekko poseren op de helling van een rots. Om dit te bereiken, maakt het gebruik van de intermoleculaire krachten tussen het gesteente en de filamenten van zijn benen..
Elk van deze filamenten heeft een zwakke wisselwerking met het oppervlak waarop het kleine reptiel klimt, maar aangezien er duizenden zijn, oefenen ze een kracht uit die evenredig is met het gebied van hun benen, sterk genoeg zodat ze gehecht blijven en kunnen klimmen. Gekko's zijn ook in staat om op gladde en perfecte oppervlakken zoals glas te klimmen..
Alkanen
Alkanen zijn verzadigde koolwaterstoffen die ook interageren door Londense troepen. Hun moleculaire structuren bestaan eenvoudigweg uit koolstofatomen en waterstofatomen die zijn verbonden door enkele bindingen. Omdat het verschil in elektronegativiteiten tussen C en H erg klein is, zijn het apolaire verbindingen.
Dus methaan, CH4, de kleinste koolwaterstof van allemaal, het kookt bij -161,7 ° C. Als C en H aan het skelet worden toegevoegd, worden andere alkanen met hogere molecuulgewichten verkregen.
Zo ontstaan ethaan (-88,6ºC), butaan (-0,5ºC) en octaan (125,7ºC). Merk op hoe hun kookpunten toenemen naarmate de alkanen zwaarder worden.
Dit komt doordat hun elektronische wolken meer polariseerbaar zijn en hun structuren een groter oppervlak hebben, waardoor het contact tussen hun moleculen toeneemt..
Octaan, hoewel een apolaire verbinding, heeft een hoger kookpunt dan water.
Halogenen en gassen
Londense strijdkrachten zijn ook aanwezig in veel gasvormige stoffen. Bijvoorbeeld moleculen van Ntwee, H.twee, COtwee, F.twee, Cltwee en alle edelgassen interageren via deze krachten, omdat ze een homogene elektrostatische distributie vertonen, die onmiddellijke dipolen kan hebben en aanleiding kan geven tot polarisaties.
De edelgassen zijn He (helium), Ne (neon), Ar (argon), Kr (krypton), Xe (xenon) en Rn (radon). Van links naar rechts nemen hun kookpunten toe met toenemende atoommassa's: -269, -246, -186, -152, -108 en -62 ºC.
Halogenen werken ook via deze krachten in. Fluor is bij kamertemperatuur net als chloor een gas. Broom, met een hogere atomaire massa, wordt onder normale omstandigheden aangetroffen als een roodachtige vloeistof, en jodium vormt tenslotte een paarse vaste stof die snel sublimeert omdat het zwaarder is dan andere halogenen.
Referenties
- Whitten, Davis, Peck & Stanley. Chemie. (8e ed.). CENGAGE Leren, p 452-455.
- Angeles Mendez. (22 mei 2012). Verspreidingskrachten (vanuit Londen). Hersteld van: quimica.laguia2000.com
- London Dispersion Forces. Hersteld van: chem.purdue.edu
- Helmenstine, Anne Marie, Ph.D. (22 juni 2018). 3 soorten intermoleculaire krachten. Hersteld van: thoughtco.com
- Ryan Ilagan en Gary L. Bertrand. London Dispersion Interactions. Genomen uit: chem.libretexts.org
- ChemPages Netorials. London Forces. Hersteld van: chem.wisc.edu
- Kamereon. (22 mei 2013). Gekko's: De gekko en de krachten van Van der waals. Hersteld van: almabiologica.com



Niemand heeft nog op dit artikel gereageerd.