
Karakteristieke bases en voorbeelden

De bases het zijn al die chemische verbindingen die protonen kunnen accepteren of elektronen kunnen doneren. In de natuur of kunstmatig zijn er zowel anorganische als organische basen. Daarom kan het gedrag ervan worden voorspeld voor veel ionische moleculen of vaste stoffen..
Wat een base echter onderscheidt van de rest van de chemische stoffen, is de duidelijke neiging om elektronen te doneren in vergelijking met bijvoorbeeld soorten met een lage elektronendichtheid. Dit is alleen mogelijk als het elektronische paar is gelokaliseerd. Als gevolg hiervan hebben basen elektronenrijke gebieden, δ-.

Met welke organoleptische eigenschappen kunnen de basen worden geïdentificeerd? Het zijn doorgaans bijtende stoffen die bij lichamelijk contact ernstige brandwonden veroorzaken. Tegelijkertijd voelen ze zeepachtig aan en lossen ze gemakkelijk vetten op. Bovendien zijn de smaken bitter.
Waar zijn ze in het dagelijks leven? Een commerciële en routinematige bron van stichtingen zijn schoonmaakproducten, van wasmiddelen tot handzepen. Om deze reden kan het beeld van bellen die in de lucht zweven, helpen om de bases te onthouden, ook al zijn er achter hen veel fysisch-chemische verschijnselen..
Veel basissen vertonen totaal verschillende eigenschappen. Sommige hebben bijvoorbeeld een vieze en sterke geur, zoals organische amines. Anderen daarentegen, zoals ammoniak, zijn doordringend en irriterend. Het kunnen ook kleurloze vloeistoffen of ionische witte vaste stoffen zijn..
Alle basen hebben echter één ding gemeen: ze reageren met zuren om oplosbare zouten te produceren in polaire oplosmiddelen, zoals water..
Artikel index
- 1 Kenmerken van de onderstellen
- 1.1 Fysieke eigenschappen
- 1.2 Sterkte van een basis
- 1,3 pH groter dan 7
- 1.4 Vermogen om zuren te neutraliseren
- 1.5 Oxide-reductiecapaciteit
- 1.6 Laat OH los-
- 1.7 Ze hebben stikstofatomen of substituenten die elektronendichtheid aantrekken
- 2 Voorbeelden van bases
- 2.1 NaOH
- 2.2 CH3OCH3
- 2.3 Alkalihydroxiden
- 2.4 Organische basen
- 2,5 NaHC03
- 3 referenties
Kenmerken van de bases

Welke specifieke kenmerken moeten alle bases hebben, afgezien van wat al is genoemd? Hoe kunnen ze protonen accepteren of elektronen doneren? Het antwoord ligt in de elektronegativiteit van de atomen van het molecuul of ion; en van alle is zuurstof de overheersende, vooral wanneer het wordt aangetroffen als een hydroxylion, OH-.
Fysieke eigenschappen
De basen hebben een zure smaak en zijn, met uitzondering van ammoniak, reukloos. De textuur is glad en kan de kleur van lakmoespapier veranderen in blauw, methyloranje in geel en fenolftaleïne in paars..
Sterkte van een basis
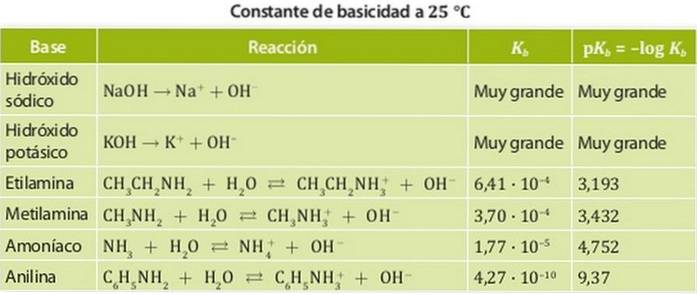
Bases worden ingedeeld in sterke basen en zwakke basissen. De sterkte van een basis is geassocieerd met zijn evenwichtsconstante, daarom worden deze constanten in het geval van basen basiciteitsconstanten Kb genoemd.
Sterke basen hebben dus een grote basiciteitsconstante, zodat ze de neiging hebben om volledig te dissociëren. Voorbeelden van deze zuren zijn basen zoals natrium- of kaliumhydroxide, waarvan de basiciteitsconstanten zo groot zijn dat ze niet in water kunnen worden gemeten..
Aan de andere kant is een zwakke basis er een waarvan de dissociatieconstante laag is, dus het is in chemisch evenwicht.
Voorbeelden hiervan zijn ammoniak en aminen waarvan de zuurgraadconstanten in de orde van 10 zijn-4. Figuur 1 toont de verschillende zuurgraadconstanten voor verschillende basen.
pH groter dan 7
De pH-schaal meet de alkaliteit of zuurgraad van een oplossing. De schaal loopt van nul tot 14. Een pH lager dan 7 is zuur. Een pH groter dan 7 is basisch. Middelpunt 7 vertegenwoordigt een neutrale pH. Een neutrale oplossing is noch zuur noch alkalisch.
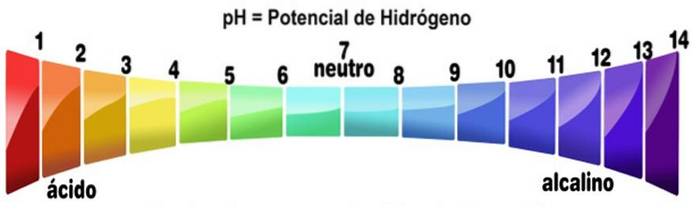
De pH-schaal wordt verkregen als functie van de concentratie van H+ in de oplossing en is omgekeerd evenredig daarmee. Basen verhogen, door de concentratie van protonen te verlagen, de pH van een oplossing.
Vermogen om zuren te neutraliseren
Arrhenius stelt in zijn theorie dat zuren, doordat ze protonen kunnen genereren, op de volgende manier reageren met de hydroxyl van de basen om zout en water te vormen:
HCl + NaOH → NaCl + HtweeOF.
Deze reactie wordt neutralisatie genoemd en vormt de basis van de analytische techniek die titratie wordt genoemd..
Oxideverminderingscapaciteit
Gezien hun vermogen om geladen soorten te produceren, worden basen gebruikt als medium voor elektronenoverdracht in redoxreacties..
Basen hebben ook de neiging om te oxideren, omdat ze het vermogen hebben om vrije elektronen te doneren..
De basen bevatten OH-ionen. Ze kunnen handelen om elektronen te doneren. Aluminium is een metaal dat reageert met basen.
2Al + 2NaOH + 6HtweeO → 2NaAl (OH)4+3Htwee
Ze corroderen niet veel metalen, omdat metalen de neiging hebben elektronen te verliezen in plaats van te accepteren, maar basen zijn zeer corrosief voor organische stoffen zoals die waaruit het celmembraan bestaat..
Deze reacties zijn meestal exotherm, wat ernstige brandwonden veroorzaakt bij contact met de huid, dus dit type stof moet met zorg worden behandeld. Figuur 3 is de veiligheidsindicator wanneer een stof bijtend is.

Ze laten OH los-
Om te beginnen, de OH- Het kan in veel verbindingen aanwezig zijn, voornamelijk in metaalhydroxiden, omdat het in het gezelschap van metalen de neiging heeft om protonen te "rukken" om water te vormen. Een base kan dus elke stof zijn die dit ion in oplossing afgeeft door een oplosbaarheidsevenwicht:
M (OH)twee <=> M.twee+ + 2OH-
Als het hydroxide erg oplosbaar is, wordt het evenwicht volledig naar rechts van de chemische vergelijking verschoven en spreken we van een sterke base. M (OH)twee , in plaats daarvan is het een zwakke base, aangezien het zijn OH-ionen niet volledig afgeeft- in water. Een keer de OH- geproduceerd kan elk zuur eromheen neutraliseren:
Oh- + HA => A- + H.tweeOF
En dus de OH- deprotoneert zuur HA om in water te veranderen. Waarom? Omdat het zuurstofatoom erg elektronegatief is en door de negatieve lading ook een overmatige elektronendichtheid heeft.
O heeft drie paar vrije elektronen en kan ze allemaal doneren aan het gedeeltelijk positief geladen H-atoom, δ +. Evenzo bevordert de grote energiestabiliteit van het watermolecuul de reactie. Met andere woorden: HtweeOf het is veel stabieler dan HA, en als dit waar is, zal de neutralisatiereactie plaatsvinden.
Geconjugeerde basen
En hoe zit het met OH- nu al-? Beide zijn basen, met het verschil dat A- is de geconjugeerde basis zuur HA. Bovendien, A- is een veel zwakkere basis dan OH-. Vanaf hier wordt de volgende conclusie getrokken: een base reageert om een zwakkere te genereren.
Baseren Sterk + Zuur Sterk => Basis Zwak + Zuur Zwak
Zoals blijkt uit de algemene chemische vergelijking, geldt hetzelfde voor zuren.
Geconjugeerde base A- kan een molecuul deprotoneren in een reactie die bekend staat als hydrolyse:
NAAR- + H.tweeOF <=> HA + OH-
In tegenstelling tot OH-, het brengt een evenwicht tot stand wanneer het wordt geneutraliseerd met water. Nogmaals, het is omdat A- het is een veel zwakkere base, maar voldoende om een verandering in de pH van de oplossing teweeg te brengen.
Daarom zijn al die zouten die A bevatten- ze staan bekend als basiszouten. Een voorbeeld hiervan is natriumcarbonaat, NatweeCO3, die na het oplossen de oplossing baseert door de hydrolysereactie:
CO3twee- + H.tweeOF <=> HCO3- + Oh-
Ze hebben stikstofatomen of substituenten die elektronendichtheid aantrekken
Een basis is niet alleen ionische vaste stoffen met OH-anionen- in hun kristalrooster kunnen ze ook andere elektronegatieve atomen hebben, zoals stikstof. Dit soort basen behoort tot de organische chemie, en een van de meest voorkomende zijn aminen.
Wat is de aminegroep? R-NHtwee. Op het stikstofatoom bevindt zich een niet-gedeeld elektronenpaar, dat kan, evenals de OH-, een watermolecuul deprotoneren:
R-NHtwee + H.tweeOF <=> RNH3+ + Oh-
Het evenwicht is sterk naar links verschoven, aangezien amine, hoewel basisch, veel zwakker is dan OH-. Merk op dat de reactie vergelijkbaar is met die gegeven voor het ammoniakmolecuul:
NH3 + H.tweeOF <=> NH4+ + Oh-
Alleen aminen kunnen het kation NH niet goed vormen4+hoewel RNH3+ is het ammoniumkation met een monosubstitutie.
En kan het reageren met andere verbindingen? Ja, bij iedereen die voldoende zure waterstof heeft, ook als de reactie niet volledig verloopt. Dat wil zeggen, alleen een zeer sterk amine reageert zonder evenwicht tot stand te brengen. Evenzo kunnen amines hun elektronenpaar doneren aan andere soorten dan H (zoals alkylradicalen: -CH3.
Basen met aromatische ringen
Amines kunnen ook aromatische ringen hebben. Als het elektronenpaar "verloren" kan gaan in de ring, omdat de ring elektronendichtheid aantrekt, zal de basiciteit ervan afnemen. Waarom? Omdat hoe meer gelokaliseerd genoemd paar zich in de structuur bevindt, hoe sneller het zal reageren met de elektronenarme soort.
Bijvoorbeeld NH3 het is eenvoudig omdat het paar elektronen nergens heen kan. Hetzelfde gebeurt met aminen, of ze nu primair zijn (RNHtwee), secundair (RtweeNH) of tertiair (R3N). Deze zijn basischer dan ammoniak omdat stikstof, naast wat zojuist is uitgelegd, hogere elektronische dichtheden van de R-substituenten aantrekt, waardoor δ toeneemt.-.
Maar als er een aromatische ring is, kan het paar daarin resoneren, waardoor het onmogelijk wordt om deel te nemen aan de vorming van bindingen met H of andere soorten. Daarom hebben aromatische aminen de neiging om minder basisch te zijn, tenzij het elektronenpaar gefixeerd blijft op stikstof (zoals bij het pyridinemolecuul).
Voorbeelden van bases
NaOH
Natriumhydroxide is een van de meest gebruikte basen ter wereld. De toepassingen zijn ontelbaar, maar onder hen kunnen we het gebruik ervan noemen om sommige vetten te verzepen en zo basische zouten van vetzuren (zepen) te maken.
CH3OCH3
Structureel gezien lijkt aceton geen protonen te accepteren (of elektronen te doneren), maar toch, ook al is het een zeer zwakke base. Dit komt omdat het elektronegatieve O-atoom de elektronenwolken van de CH-groepen aantrekt.3, accentuering van de aanwezigheid van zijn twee elektronenparen (: O :).
Alkalihydroxiden
Behalve NaOH zijn alkalimetaalhydroxiden ook sterke basen (met de kleine uitzondering van LiOH). Zo zijn er onder andere de volgende:
-KOH: kaliumhydroxide of bijtende potas, het is een van de meest gebruikte basen in het laboratorium of in de industrie vanwege zijn grote ontvettingsvermogen.
-RbOH: rubidiumhydroxide.
-CsOH: cesiumhydroxide.
-FrOH: franciumhydroxide, waarvan theoretisch wordt aangenomen dat het basiciteit een van de sterkste is die ooit is gekend.
Biologische basen
-CH3CHtweeNHtwee: ethylamine.
-LiNHtwee: lithiumamide. Samen met natriumamide, NaNHtwee, ze zijn een van de sterkste organische basen. In hen het amide-anion, NHtwee- het is de basis die water deprotoneert of reageert met zuren.
-CH3ONa: natriummethoxide. Hier is de basis het anion CH3OF-, die kan reageren met zuren om methanol te geven, CH3Oh.
-Grignard-reagentia: hebben een metaalatoom en een halogeen, RMX. In dit geval is radicaal R de base, maar niet juist omdat het een zure waterstof wegneemt, maar omdat het zijn elektronenpaar opgeeft dat het deelt met het metaalatoom. Bijvoorbeeld: ethylmagnesiumbromide, CH3CHtweeMgBr. Ze zijn erg handig bij organische synthese.
NaHCO3
Zuiveringszout wordt gebruikt om de zuurgraad in milde omstandigheden te neutraliseren, bijvoorbeeld in de mond als additief in tandpasta's.
Referenties
- Merck KGaA. (2018). Biologische basen. Ontleend aan: sigmaaldrich.com
- Wikipedia. (2018). Bases (scheikunde). Ontleend aan: es.wikipedia.org
- Chemie 1010. Zuren en basen: wat ze zijn en waar ze worden aangetroffen. [Pdf]. Genomen uit: cactus.dixie.edu
- Zuren, basen en de pH-schaal. Genomen uit: 2.nau.edu
- De Bodner Group. Definities van zuren en basen en de rol van water. Genomen uit: chemed.chem.purdue.edu
- Chemie LibreTexts. Bases: eigenschappen en voorbeelden. Genomen uit: chem.libretexts.org
- Shiver & Atkins. (2008). Anorganische scheikunde. Aan Zuren en basen. (vierde druk). Mc Graw Hill.
- Helmenstine, Todd. (4 augustus 2018). Namen van 10 basissen. Hersteld van: thoughtco.com



Niemand heeft nog op dit artikel gereageerd.