
Onderdelen en voorbeelden van chemische vergelijkingen

De reactievergelijking het is een schematische weergave van enkele kenmerken van een chemische reactie. Er kan ook worden gezegd dat de chemische vergelijking de veranderingen beschrijft die worden ervaren door de verschillende stoffen die bij een reactie betrokken zijn.
De formules en symbolen van de verschillende deelnemende stoffen worden in de chemische vergelijking geplaatst en geven duidelijk het aantal atomen aan van elk element dat aanwezig is in de verbindingen, dat verschijnt als een subscript en niet kan worden gewijzigd door de vergelijking in evenwicht te brengen.
De chemische vergelijking moet evenwichtig lijken, dat wil zeggen dat het aantal atomen van zowel reactanten als producten gelijk moet zijn. Op deze manier wordt de wet van behoud van materie nageleefd. Het is wenselijk dat de getallen die worden gebruikt bij het balanceren van de vergelijkingen, gehele getallen zijn.
Deze vergelijkingen onthullen niet de opeenvolgende stappen, noch door welke mechanismen de reactanten in producten worden omgezet..
Dat is waarom, hoewel ze erg nuttig zijn om te begrijpen waar een chemische reactie naartoe gaat, het ons niet in staat stelt om de moleculaire aspecten ervan te begrijpen of hoe deze wordt beïnvloed door bepaalde variabelen; zoals pH, viscositeit, reactietijd, roersnelheid, onder anderen.
Artikel index
- 1 Delen van een chemische vergelijking
- 1.1 Locatie van reagentia en producten
- 1.2 Balanceren van chemische vergelijkingen
- 1.3 Fysische toestanden van de componenten van de chemische vergelijking
- 1.4 Veranderingen in fysieke toestand
- 2 Voorbeeld van chemische vergelijkingen
- 2.1 - Fotosynthese
- 2.2 - Cellulaire ademhaling
- 2.3 - Reacties van gemeenschappelijke elementen
- 3 referenties
Delen van een chemische vergelijking
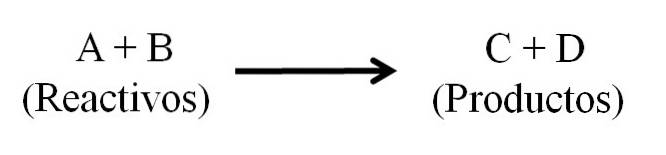
Er zijn in principe drie hoofdonderdelen van een chemische vergelijking: de reactanten, de producten en de pijl die de richting van de chemische reactie aangeeft..
Locatie van reagentia en producten
Alle stoffen die als reactanten functioneren en alle stoffen die producten zijn, komen voor in de chemische vergelijking. Deze stofgroepen zijn gescheiden door een pijl die de richting van de reactie aangeeft. Reagentia bevinden zich links van de pijl en producten rechts.
De pijl betekent wat wordt geproduceerd en is georiënteerd van links naar rechts (→), hoewel er bij omkeerbare reacties twee gelijkwaardige en parallelle pijlen zijn; een naar rechts, en een naar links. Het symbool (Δ) wordt meestal boven de pijl geplaatst, wat aangeeft dat er warmte is gebruikt bij de reactie..
Bovendien wordt de identificatie van de katalysator meestal op de pijl geplaatst, indien mogelijk met zijn formule of symbool. De verschillende stoffen die als reactanten verschijnen, worden gescheiden door het teken (+), wat aangeeft dat de stoffen met elkaar reageren of combineren.
In het geval van stoffen die als producten verschijnen, heeft het teken (+) niet de vorige connotatie; tenzij de reactie omkeerbaar is. Het is handig dat het teken (+) op gelijke afstand staat van de stoffen die het scheidt.
Evenwichtige chemische vergelijkingen
Het is een essentiële vereiste dat de chemische vergelijkingen goed uitgebalanceerd zijn. Hiervoor wordt een getal geplaatst dat de stoichiometrische coëfficiënt wordt genoemd. Indien nodig moet deze coëfficiënt voor de stoffen gaan die verschijnen als reactanten of producten..
Dit is zo om te bereiken dat het aantal van alle atomen van de elementen dat als reactanten verschijnt, exact gelijk is aan het aantal dat in het product voorkomt. De eenvoudigste methode om chemische vergelijkingen in evenwicht te brengen, is met vallen en opstaan..
Fysische toestanden van de componenten van de chemische vergelijking
In sommige chemische vergelijkingen wordt de fysische toestand van stoffen gemarkeerd met een onderschrift. Hiervoor worden in het Spaans de volgende afkortingen gebruikt: (s) voor de vaste toestand; (l) voor de vloeibare toestand; (g), gasvormige toestand; en (ac), waterige oplossing.
Voorbeeld: reactie van calciumcarbonaat met zoutzuur.
Dief3 (s) + 2 HCl(ac) → CaCl2 (s) + H.tweeOF(l) + CO2 g)
Veranderingen in fysieke toestand
In sommige gevallen wordt in de chemische vergelijking aangegeven of er een gas wordt geproduceerd tijdens de chemische reactie of dat er een van de geproduceerde stoffen neerslaat..
De aanwezigheid van een gas wordt aangegeven door een verticale pijl met het uiteinde naar boven gericht (↑), geplaatst aan de rechterkant van de gasvormige substantie.
Voorbeeld: reactie van zink met zoutzuur.
Zn + 2 HCl → ZnCltwee + H.twee
Als bij de chemische reactie een van de stoffen een neerslag vormt, wordt dit gesymboliseerd door een verticale pijl te plaatsen met het uiteinde naar beneden gericht (↓), geplaatst aan de rechterkant van de neergeslagen stof..
Voorbeeld: reactie van zoutzuur met zilvernitraat.
HCl + AgNO3 → HNO3 + AgCl ↓
Voorbeeld van chemische vergelijkingen
- Fotosynthese

Fotosynthese is een proces waarbij planten lichtenergie, afkomstig van zonlicht, opvangen en transformeren om de energie op te wekken die nodig is voor hun levensonderhoud. Fotosynthese wordt uitgevoerd door sommige organellen van plantencellen die chloroplasten worden genoemd.
Thylakoïden worden aangetroffen in het chloroplastmembraan, plaatsen waar chlorofylen worden aangetroffen. naar Y b, dat zijn de belangrijkste pigmenten die lichtenergie opvangen.
Hoewel fotosynthese een complex proces is, kan het worden geschetst in de volgende chemische vergelijking:
6 COtwee + 6 uurtweeO → C6H.12OF6 + 6 Otwee↑ ΔGº = 2.870 kJ / mol
C6H.12OF6 Het is de formule voor glucose, een koolhydraat dat wordt gemetaboliseerd voor de productie van ATP; verbinding die het belangrijkste reservoir van energie is in de meeste levende wezens. Bovendien wordt NADPH gegenereerd uit glucose, een co-enzym dat nodig is voor veel reacties..
- Cellulaire ademhaling
Cellen gebruiken zuurstof voor het metabolisme van tal van stoffen die in ingenomen voedsel aanwezig zijn. Ondertussen wordt ATP gebruikt als energiebron voor de activiteiten die worden uitgevoerd door levende wezens, waarbij koolstofdioxide en water worden geproduceerd in deze processen..
Als glucose wordt gebruikt als een model voor een gemetaboliseerde stof, kan de ademhaling schematisch worden weergegeven met behulp van de volgende chemische vergelijking:
C6H.12OF6 + 6 Otwee → 6 COtwee + 6 uurtweeOF
- Algemene elementreacties
Ontbindingsreactie
Een verbinding of verbindingen dissociëren en vormen andere verschillende verbindingen met hun atomen:
2 KClO3 (s) → 2 KCl(s) + 3 O2 g)
Verplaatsingsreactie
Een metaal reageert met een verbinding en vervangt een daarin aanwezig metaal:
Mg(s) + CURSUS4 (ac) → Cu(s) + MgSO4 (ac)
Eliminatiereactie
Bij dit type reactie neemt het aantal atomen of groepen dat aan een koolstofatoom is gebonden af:
CH3-CHtweeBr + NaOH → HtweeC = CHtwee + H.tweeO + NaBr
Hydratatiereactie
Het is een reactie waarbij een verbinding een molecuul water toevoegt. Deze reactie is belangrijk bij de bereiding van alcoholen:
H.tweeC = CHtwee + H.tweeO → HtweeC-CHtweeOh
Neutralisatie-reactie
Een base of base reageert met een zuur en produceert een zout en water:
HCl(ac) + NaOH(ac) → NaCl(ac) + H.tweeOF(l)
Synthese reactie
Bij dit type reactie worden twee of meer stoffen gecombineerd om een nieuwe verbinding te maken:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Dubbele verplaatsingsreactie (metathese)
Bij dit type reactie is er uitwisseling van positieve en negatieve ionen om nieuwe verbindingen te vormen:
AgNO3 (ac) + NaCl(ac) → AgCl(s) + Oudere broer3 (ac)
Referenties
- Flores, J. (2002). Chemie. Editie 1het was. Redactioneel Santillana
- Mathews, C. K., Van Holde, K. E., en Ahern, K. G. (2002). Biochemie. 3het was Editie. Uitgever Pearson Addison Wesley
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2019). Reactievergelijking. Hersteld van: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20 september 2019). Wat is een chemische vergelijking? Hersteld van: thoughtco.com



Niemand heeft nog op dit artikel gereageerd.