
Boorgeschiedenis, eigenschappen, structuur, gebruik
De boor Het is een niet-metalen element dat aan het hoofd van groep 13 van het periodiek systeem staat en wordt weergegeven door het chemische symbool B. Het atoomnummer is 5 en het is het enige niet-metalen element in zijn groep; hoewel sommige chemici het als een metalloïde beschouwen.
Het verschijnt als een zwartachtig bruin poeder en wordt aangetroffen in een verhouding van 10 ppm ten opzichte van de aardkorst. Daarom is het niet een van de meest voorkomende elementen.

Het wordt gevonden als onderdeel van verschillende mineralen zoals borax of natriumboraat, dit is het meest voorkomende boormineraal. Er is ook kurniet, een andere vorm van natriumboraat; colemaniet of calciumboraat; en ulexiet, natrium- en calciumboraat.
Boraten worden gewonnen in de Verenigde Staten, Tibet, China en Chili met een wereldproductie van ongeveer twee miljoen ton per jaar.
Dit element heeft dertien isotopen, waarvan de meest voorkomende elfB, dat 80,1 gew.% Van het boor uitmaakt, en 10B, die de resterende 19,9% vormt.
Boor is een essentieel sporenelement voor planten, dat tussenkomt in de synthese van enkele vitale planteneiwitten en draagt bij tot de opname van water. Bij zoogdieren blijkt het noodzakelijk te zijn voor de gezondheid van de botten.
Hoewel borium in 1808 werd ontdekt door de Engelse chemicus Sir Humphry Davy, en de Franse chemici Jacques Thérnard en Joseph Gay-Lussac, werd borax sinds het begin van onze jaartelling in China gebruikt bij de vervaardiging van geëmailleerd aardewerk..
Boor en zijn verbindingen hebben vele toepassingen en toepassingen, variërend van het gebruik bij het conserveren van voedsel, met name margarine en vis, tot het gebruik bij de behandeling van kankerachtige tumoren van de hersenen, blaas, prostaat en andere organen..
Borium is slecht oplosbaar in water, maar zijn verbindingen zijn dat wel. Dit kan een concentratiemechanisme van boor zijn, maar ook een bron van vergiftiging met het element..
Artikel index
- 1 Geschiedenis
- 1.1 Achtergrond
- 1.2 Element ontdekking
- 1.3 Identificatie en isolatie
- 2 Eigenschappen
- 2.1 Fysieke beschrijving
- 2.2 Molaire massa
- 2.3 Smeltpunt
- 2.4 Kookpunt
- 2.5 Dichtheid
- 2.6 Warmte van fusie
- 2.7 Verdampingswarmte
- 2.8 Molaire warmtecapaciteit
- 2.9 Ionisatie-energie
- 2.10 Elektronegativiteit
- 2.11 Atoomradius
- 2.12 atomair volume
- 2.13 Thermische geleidbaarheid
- 2.14 Elektrische weerstand
- 2.15 Hardheid
- 2.16 Reactiviteit
- 3 Structuur en elektronenconfiguratie van boor
- 3.1 Links en structurele eenheden in boor
- 3.2 α-rhombohedraal boor
- 3.3 β-romboëdrische boor
- 3.4 Boor-γ steenzout
- 3,5 Kubisch en amorf
- 3.6 Borofenen
- 3.7 Elektronische configuratie
- 4 Verkrijgen
- 5 toepassingen
- 5.1 In de industrie
- 5.2 In de geneeskunde
- 5.3 Biologische werking
- 6 Risico's en voorzorgsmaatregelen
- 7 referenties
Verhaal
Achtergrond
Sinds de oudheid heeft de mens boorverbindingen bij verschillende activiteiten gebruikt. Borax, een mineraal dat bekend staat als tincal, werd in 300 na Christus in China gebruikt. bij de productie van emailkeramiek.
De Perzische alchemist Rhazes (865-925) maakte voor het eerst melding van boorverbindingen. Rhazes classificeerden de mineralen in zes klassen, waarvan er één de boracios was die boor omvatte.
Agricola rapporteerde rond 1600 het gebruik van borax als stroom in de metallurgie. In 1777 werd de aanwezigheid van boorzuur herkend in een hete bron in de buurt van Florence.
Element ontdekking
Humphry Davy observeerde door elektrolyse van een borax-oplossing de opeenhoping van een zwart neerslag op een van de elektroden. Hij verwarmde ook booroxide (B.tweeOF3) met kalium, waardoor een zwartachtig bruin poeder werd geproduceerd dat de bekende vorm van boor was.
Gay-Lussac en Thénard reduceerden boorzuur bij hoge temperaturen in aanwezigheid van ijzer om boor te produceren. Ze toonden ook het omgekeerde proces, dat wil zeggen, waarbij boorzuur een product is van de oxidatie van boor.
Identificatie en isolatie
Jöns Jakob Berzelius (1827) slaagde erin boor als nieuw element te identificeren. In 1892 slaagde de Franse chemicus Henri Moissan erin om boor te produceren met een zuiverheid van 98%. Hoewel er wordt opgemerkt dat boor in zuivere vorm werd geproduceerd door de Amerikaanse chemicus Ezekiel Weintraub, in het jaar 1909.
Eigendommen
Fysieke beschrijving
Kristallijn vast of amorf zwartbruin poeder.
Molaire massa
10,821 g / mol.
Smeltpunt
2076 ºC.
Kookpunt
3927 ºC.
Dichtheid
-Vloeistof: 2,08 g / cm3.
-Kristallijn en amorf bij 20 ºC: 2,34 g / cm3.
Warmte van fusie
50,2 kJ / mol.
Warmte van verdamping
508 kJ / mol.
Molaire warmtecapaciteit
11.087 J / (mol K)
Ionisatieenergie
-Eerste niveau: 800,6 kJ / mol.
-Tweede niveau: 2.427 kJ / mol.
-Derde niveau: 3.659,7 kJ / mol.
Elektronegativiteit
2.04 op de schaal van Pauling.
Atomaire radio
90 uur (empirisch).
Atoomvolume
4,16 cm3/ mol.
Warmtegeleiding
27,4 W / m.K
Elektrische weerstand
~ 106 Ω.m (bij 20ºC).
Boor bij hoge temperaturen is een goede elektrische geleider, maar bij kamertemperatuur wordt het bijna een isolator.
Hardheid
~ 9,5 op de schaal van Mohs.
Reactiviteit
Boor wordt niet aangetast door zoutzuur bij kookpunt. Het wordt echter door heet salpeterzuur omgezet in boorzuur (H.3BO3Borium gedraagt zich chemisch als een niet-metaal.
Reageert met alle halogenen om zeer reactieve trihalogeniden te geven. Deze hebben de algemene formule BX3, waarbij X staat voor halogeen.
Het combineert met verschillende elementen om boriden te maken. Sommigen van hen behoren tot de moeilijkste stoffen; bijvoorbeeld boornitride (BN). Borium combineert met zuurstof om boortrioxide te vormen.
Structuur en elektronenconfiguratie van boor
Links en structurele eenheden in boor
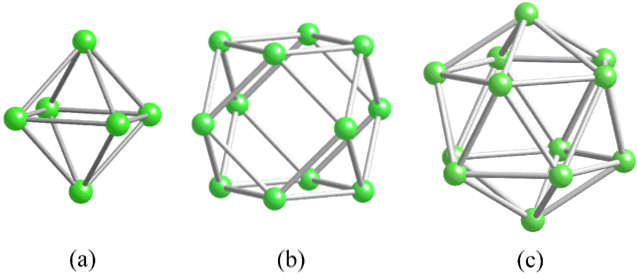
Voordat we de structuren van boor (kristallijn of amorf) aanpakken, is het essentieel om in gedachten te houden hoe de atomen ervan kunnen worden gekoppeld. De B-B-binding is in wezen covalent; Niet alleen dat, maar omdat booratomen van nature een elektronisch tekort vertonen, zullen ze proberen om het op de een of andere manier in hun obligaties te voorzien..
In boor wordt een speciaal type covalente binding waargenomen: die met drie centra en twee elektronen, 3c2e. Hier delen drie booratomen twee elektronen en definiëren ze een driehoek, een van de vele vlakken die te vinden zijn in hun structurele veelvlakken (bovenste afbeelding).
Van links naar rechts hebben we: octaëder (a, B6), kuboctaëder (b, B12), en de isocashedron (c, B12 ook). Al deze eenheden hebben één kenmerk gemeen: ze zijn elektronarm. Daarom hebben ze de neiging om covalent met elkaar te verbinden; en het resultaat is een feest met geweldige links.
In elke driehoek van deze veelvlakken is de 3c2e-binding aanwezig. Anders zou niet kunnen worden uitgelegd hoe boor, dat volgens de Valencia Bond Theory slechts drie covalente bindingen kan vormen, tot vijf bindingen in deze veelvlakkige eenheden kan hebben..
Boorstructuren bestaan dan uit een rangschikking en herhaling van deze eenheden die uiteindelijk een kristal (of een amorfe vaste stof) definiëren.
Α-rhombohedraal boor
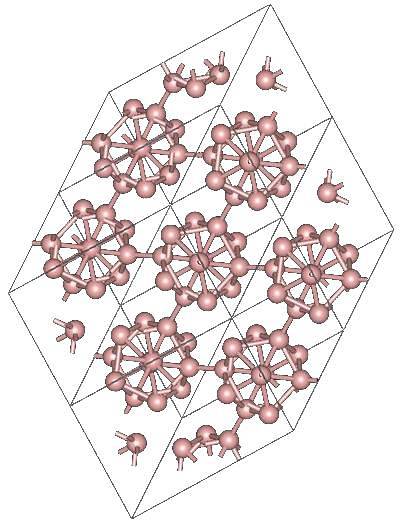
Er kunnen andere veelvlakkige booreenheden zijn, evenals een die uit slechts twee atomen bestaat, B.tweeeen boor "lijn" die moet worden gebonden aan andere atomen vanwege zijn hoge elektronische tekortkoming.
De icosaëder is verreweg de geprefereerde eenheid van boor; degene die het beste bij je past. In de afbeelding hierboven kun je bijvoorbeeld zien hoe deze B-eenheden12 verstrengelen om het rhombohedrale kristal van Boron-α te definiëren.
Als je een van deze icosahedra zou willen isoleren, zou het een gecompliceerde taak zijn, omdat het elektronische tekort hen dwingt een kristal te definiëren waar elk de elektronen bijdraagt die de andere buren nodig hebben..
Β-rhombohedraal boor
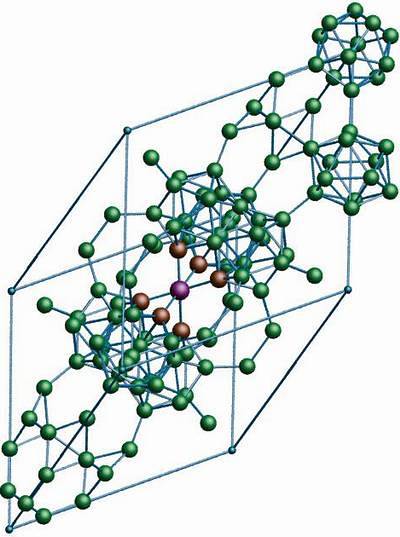
De allotrope boor β-rhombohedral heeft, zoals de naam al aangeeft, rhombohedrale kristallen zoals boor-α; het verschilt echter in zijn structurele eenheden. Het ziet eruit als een buitenaards schip gemaakt van booratomen.
Als je goed kijkt, zijn de icosaëdereenheden op een discrete en gefuseerde manier (in het midden) te zien. Er zijn ook B-units10 en solitaire booratomen die als brug fungeren voor de genoemde eenheden. Dit is van alles de meest stabiele boorallotroop.
Steenzout van boor-γ
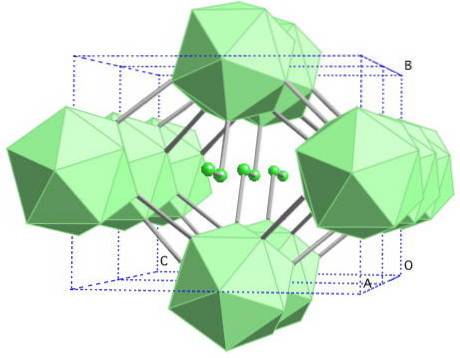
In deze boorallotroop zijn de B-eenheden gecoördineerdtwee en B12. De B.twee is zo elektronisch gebrekkig dat het daadwerkelijk elektronen uit B verwijdert12 en daarom zit er een ionisch karakter in deze vaste stof. Dat wil zeggen, ze zijn niet alleen covalent gebonden, maar er is ook een elektrostatische aantrekkingskracht van het type [Btwee-] [B12+.
Borium-γ kristalliseert tot een steenzoutstructuur, dezelfde als voor NaCl. Het wordt verkregen door andere boorallotropen te onderwerpen aan hoge drukken (20 GPa) en temperaturen (1800 ° C), om later onder normale omstandigheden stabiel te blijven. Zijn stabiliteit concurreert eigenlijk met die van β-rhombohedraal boor.
Kubisch en amorf
Andere boorallotropen bestaan uit aggregaten van B-atomen alsof ze zijn verbonden door een metaalbinding, of alsof ze ionische kristallen zijn; dat wil zeggen, het is een kubieke boor.
Eveneens, en niet minder belangrijk, is amorf boor, waarvan de rangschikking van B-eenheden12 het is willekeurig en rommelig. Verschijnt als een glasachtige vaste stof of fijn poeder van dofbruine en donkere kleuren.
Borophenes
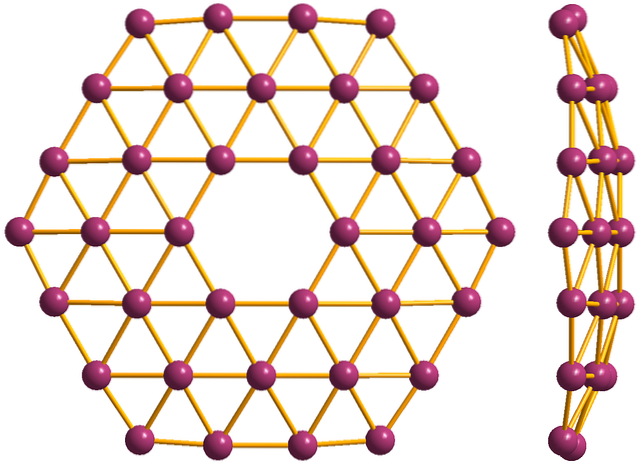
En tot slot is er de nieuwste en meest bizarre allotroop van boor: borophenes (bovenste afbeelding). Het bestaat uit een monolaag van booratomen; extreem dun en analoog aan grafeen. Merk op dat het de beroemde driehoeken behoudt, kenmerkend voor het elektronische defect dat zijn atomen ondervinden.
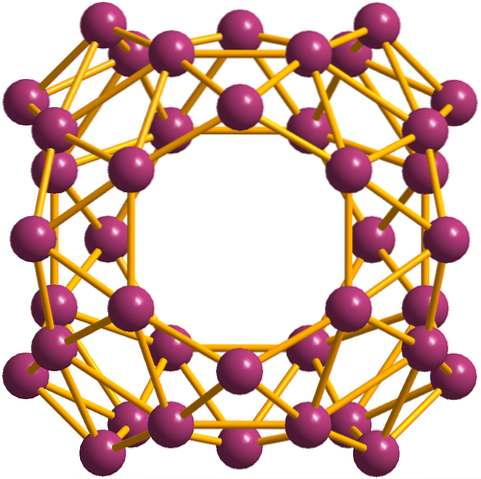
Naast de borophenes, waarvan de B36 is de eenvoudigste en kleinste, er zijn ook de boorclusters. De borosfeer (afbeelding hieronder) bestaat uit een bolvormige bolvormige kooi van veertig booratomen, B.40maar in plaats van dat ze gladde randen hebben, zijn ze abrupt en grillig:
Elektronische configuratie
De elektronenconfiguratie van boor is:
[Hij] 2stwee 2 Blz1
Het heeft daarom drie valentie-elektronen. Er zijn er nog vijf nodig om zijn valentie-octet te voltooien, en het kan nauwelijks drie covalente bindingen vormen; het zou een vierde datiefkoppeling nodig hebben om zijn octet te voltooien. Borium kan zijn drie elektronen verliezen om een oxidatietoestand van +3 te krijgen.
Het verkrijgen van
Boor wordt geïsoleerd door boorzuur te reduceren met magnesium of aluminium; methode vergelijkbaar met die van Gay-Lussac en Thénard. Het heeft de moeilijkheid om boor te verontreinigen met de boriden van deze metalen.
Een monster van hoge zuiverheid kan worden verkregen door gasfasereductie van boortrichloride of tribromide met waterstof op elektrisch verwarmde filamenten van tantaal..
Een boor met een hoge zuiverheid wordt bereid door ontleding van diboraan bij hoge temperatuur, gevolgd door zuivering door zonefusie of Czocharalski-processen..
Toepassingen
In de industrie
Elementair boor is gebruikt bij het harden van staal. In een legering met ijzer dat 0,001 tot 0,005% boor bevat. Het wordt ook gebruikt in de non-ferro-industrie, meestal als desoxidatiemiddel.
Bovendien wordt boor gebruikt als ontgasser in hooggeleidende koper- en koperlegeringen. In de halfgeleiderindustrie worden kleine hoeveelheden boor voorzichtig toegevoegd als doteringsmiddel voor silicium en germanium..
Boriumoxide (BtweeOF3) wordt gemengd met silica om een hittebestendig glas te maken (borosilicaatglas), dat wordt gebruikt in keukengerei en bepaalde laboratoriumapparatuur.
Boorcarbide (B4C) is een extreem harde stof die wordt gebruikt als schuur- en versterkingsmiddel in composietmaterialen. Aluminiumboride (AlB12) wordt gebruikt als vervanging voor diamantstof voor slijpen en polijsten.
Boor wordt gebruikt in legeringen, bijvoorbeeld zeldzame-aardemagneten, door ijzer en neodymium te legeren. De gevormde magneten worden gebruikt bij de fabricage van microfoons, magnetische schakelaars, koptelefoons en deeltjesversnellers.
In de geneeskunde
De capaciteit van de boor-10 isotoop (10B) om neutronen te vangen, is het uitzenden van α-type straling gebruikt voor de behandeling van hersentumoren in een techniek die bekend staat als Boron Neutron Capture Therapy (BNCT).
De 10Verbinding B hoopt zich op in de kankergezwel. Vervolgens wordt het tumorgebied bestraald met neutronen. Deze hebben een wisselwerking met 10B, wat de emissie van α-deeltjes veroorzaakt. Deze deeltjes hebben een hoog relatief biologisch effect en door hun grote afmeting hebben ze een klein bereik..
Daarom blijft de destructieve werking van de α-deeltjes beperkt tot de tumorcellen en wordt hun vernietiging uitgevoerd. BNCT wordt ook gebruikt bij de behandeling van kankerachtige tumoren van de nek, lever, blaas en prostaat..
Biologische werking
Een kleine hoeveelheid boor, in de vorm van boorzuur of boraat, is nodig voor de groei van veel planten. Een tekort aan boor manifesteert zich in een misvormde plantengroei; het "bruine hart" van groenten; en de "droge rot" van suikerbieten.
Boor kan in kleine hoeveelheden nodig zijn om de gezondheid van de botten te behouden. Er zijn onderzoeken die aangeven dat het gebrek aan boor een rol zou spelen bij het ontstaan van artritis. Het zou ook ingrijpen in hersenfuncties zoals geheugen en hand-oog coördinatie.
Sommige deskundigen wijzen erop dat 1,5 tot 3 mg boor in de dagelijkse voeding moet worden opgenomen.
Risico's en voorzichtigheid
Boor, booroxide, boorzuur en boraten worden als niet-toxisch beschouwd. De LD50 voor dieren is 6 g boor / kg lichaamsgewicht, terwijl stoffen met een LD50 groter dan 2 g / kg lichaamsgewicht als niet-toxisch worden beschouwd..
Aan de andere kant veroorzaakt de consumptie van meer dan 0,5 mg boor per dag gedurende 50 dagen kleine spijsverteringsproblemen, wat wijst op toxiciteit. Sommige rapporten geven aan dat een te hoge inname van boor de werking van de maag, lever, nieren en hersenen kan beïnvloeden.
Ook zijn kortdurende irriterende effecten op de nasopharynx, de bovenste luchtwegen en de ogen gemeld door blootstelling aan boor..
Meldingen van boorvergiftiging zijn schaars en in veel gevallen treedt toxiciteit op bij zeer hoge doses, hoger dan die waaraan de algemene bevolking wordt blootgesteld..
De aanbeveling is om het boorgehalte van voedingsmiddelen, met name groenten en fruit, te controleren. Gezondheidsinstanties van de overheid moeten ervoor zorgen dat de boorconcentratie van het water de toegestane limieten niet overschrijdt..
Werknemers die worden blootgesteld aan boorhoudend stof, dienen ademhalingsmaskers, handschoenen en speciale laarzen te dragen..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Allotropen van boor. Hersteld van: en.wikipedia.org
- Prof. Robert J. Lancashire. (2014). Hoorcollege 5b. Structuur van de elementen (niet-metalen, B, C). Het Department of Chemistry, University of the West Indies, Mona Campus, Kingston 7, Jamaica. Hersteld van: chem.uwimona.edu.jm
- Manisha Lalloo. (28 januari 2009). Ultrazuivere boorstructuur ontdekt. Chemistry World. Hersteld van: chemistryworld.com
- Bell Terence. (16 december 2018). Een profiel van het metaalborium. Hersteld van: thebalance.com
- De redactie van Encyclopaedia Britannica. (2019). Borium. Hersteld van: britannica.com
- Agentschap voor giftige stoffen en ziekteregistratie. (2010). ToxFAQs ™ op boor. [Pdf]. Hersteld van: atsdr.cdc.gov
- Helmenstine, Anne Marie, Ph.D. (6 februari 2019). Borium Chemische en fysische eigenschappen. Hersteld van: thoughtco.com



Niemand heeft nog op dit artikel gereageerd.