
Natriumbromide (NaBr) structuur, eigenschappen en toepassingen
De natriumbromide het is een chemische soort die behoort tot de zouten van anorganische oorsprong. De structuur is samengesteld uit het halogeenbroom en het metaalelement natrium in een verhouding van 1: 1. De chemische formule is NaBr en het bevindt zich in een vaste toestand van aggregatie onder standaard temperatuur- en drukomstandigheden (25 ° C en 1 atm).
Normaal gesproken kan het worden gezien als een wit poeder en wordt het beschouwd als een kristallijne verbinding die ook hygroscopisch gedrag vertoont; dat wil zeggen, het heeft het vermogen om vocht uit zijn omgeving op te nemen.

Evenzo heeft natriumbromide fysieke kenmerken die sterk lijken op een andere ionische verbinding van hetzelfde metaal: natriumchloride. Dit chloride wordt weergegeven als NaCl, beter bekend als keukenzout of keukenzout..
Het heeft een groot aantal toepassingen in verschillende wetenschapsgebieden; Het wordt bijvoorbeeld gebruikt bij de productie van verschillende soorten medicijnen (onder andere sedativa, hypnotica, anticonvulsiva), maar ook in organische syntheses en zelfs in fotografietoepassingen..
Artikel index
- 1 Chemische structuur
- 1.1 Chemische synthese
- 2 Eigenschappen
- 3 toepassingen
- 4 referenties
Chemische structuur
Zoals eerder vermeld, komt natriumbromide voor in de vaste fase en heeft het, net als veel andere zouten van anorganische aard, een kristallijne structurele conformatie..
Dit kristallijne molecuul, bestaande uit een broom- en een waterstofatoom, heeft een kubusvormige conformatie met het gezicht in het midden, zoals de halogenide-zouten van hetzelfde metaal (NaI, NaF en NaCl).
Deze moleculaire rangschikking vormt de structurele basis van veel verbindingen, waarbij de ordening zo wordt uitgevoerd dat elk ion in het midden van een octaëdrische figuur blijft, zoals weergegeven in de volgende afbeelding.
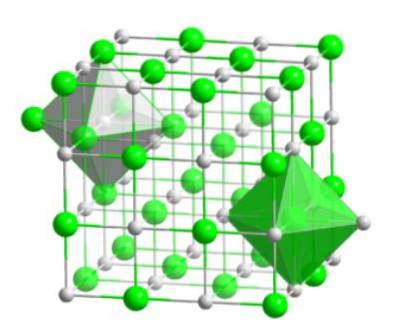
In dit type kristal kan worden waargenomen hoe elk van de ionen om zich heen zes andere ionen heeft - die een tegengestelde elektrische lading hebben - die zich aan de uiteinden van de octaëdrische figuur bevinden..
Evenzo impliceert de structuur van deze ionische stof dat het een hoog smeltpunt heeft van ongeveer 747 ° C, omdat het commercieel wordt aangetroffen in zijn twee vormen: een watervrije soort (zonder watermoleculen) en een gedehydrateerde soort (met twee watermoleculen in zijn structurele vorm). formule (NaBr 2HtweeO)), waarvan de smeltpunten verschillen.
Chemische synthese
Natriumbromide ontstaat door de chemische reactie die plaatsvindt tussen waterstofbromide (BrH, een waterstofhalogenide in de gasfase) en natriumhydroxide (NaOH, een sterke base in de vaste fase en met hygroscopische eigenschappen).
Op deze manier wordt het commercieel vervaardigd door een overmaat broom toe te voegen aan een NaOH-oplossing. Aldus wordt een bromide / broom-mengsel gevormd. Vervolgens worden de resulterende producten verdampt tot ze droog zijn en worden ze behandeld met koolstof om de bromaat-ionenreductiereactie (BrO3-) aan het bromide-ion (Br-.
Neutralisatie
Evenzo kan dit anorganische zout ook worden geproduceerd door een neutralisatiereactie van natriumcarbonaat (NatweeCO3) met broomzuur (HBrO3), volgens dezelfde procedure als hierboven beschreven.
Door een synthese is het mogelijk om deze stof te produceren door de reactie tussen ijzer met broom en water. Als product van deze reactie ontstaat de ferro-ferri-bromide-soort.
Later vormde deze soort (weergegeven als FeBrtwee/ FeBr3) wordt opgelost in water en er wordt een bepaalde hoeveelheid natriumcarbonaat aan toegevoegd. Ten slotte wordt de oplossing gefiltreerd en door een verdampingsproces doorlopen om uiteindelijk het natriumbromide te verkrijgen..
Eigendommen
- Het wordt gewoonlijk aangetroffen in een vaste aggregatietoestand, in de vorm van een wit poeder.
- Het heeft een kristallijne structuur, met een kubusvormige moleculaire rangschikking gecentreerd op de vlakken.
- Het smeltpunt van deze stof is ongeveer 747 ° C voor zijn watervrije vorm en 36 ° C voor zijn dihydraatvorm, waarbij ontbinding optreedt voordat het smelt..
- Het bestaat uit een natriumion (Na+) en een bromide-ion (Br-), met een molaire massa of molecuulgewicht van 102,89 g / mol.
- Het kookpunt is vrij hoog, waargenomen bij 1390 ° C (gelijk aan 2530 ° F of 1660 K).
- De oplosbaarheid van deze soort is ongeveer 94,32 g / 100 ml in water van 25 ° C, en neemt toe met toenemende temperatuur..
- Bij verhitting tot het punt waarop het uiteenvalt, geeft deze stof broom- en natriumoxidegassen vrij die als giftig worden beschouwd..
- De dichtheid van de watervrije vorm van natriumbromide is 3,21 g / cm3, terwijl die van de dihydraatverbinding 2,18 g / cm is3.
- De oplosbaarheid ervan in alcohol wordt als matig beschouwd, net als in andere oplosmiddelen zoals pyridine, ammoniak en hydrazine.
- Biedt onoplosbaarheid tegen acetonitril en aceton.
Toepassingen
- In de geneeskunde wordt het gebruikt als medicijn voor een groot aantal aandoeningen die epileptische aanvallen veroorzaken en als therapie om epilepsie te voorkomen bij patiënten met het Wolf-Hirschhorn-syndroom, evenals bij kalmerende en hypnotische behandelingen..
- In de diergeneeskunde wordt het gebruikt bij honden met epileptische aandoeningen als gevolg van de bijwerkingen van geneesmiddelen zoals primidon of fenobarbital..
- Op het gebied van de olie-industrie wordt het gebruikt bij de bereidingsprocessen van bepaalde vloeistoffen met verschillende dichtheid die in oliebronnen worden gebruikt..
- Op het gebied van biologisch onderzoek zijn de microbiocide eigenschappen ervan bewezen; dat wil zeggen, het wordt gebruikt om de ontwikkeling van verschillende soorten bacteriën te beheersen.
- In bepaalde syntheses van het organische type wordt dit anorganische zout gebruikt voor de bereiding van andere soorten bestaande uit broom. Door middel van de Finkelstein-reactie worden bijvoorbeeld bepaalde alkylhalogeniden met een hogere reactiviteit verkregen, waarvan er één vroeger op grote schaal in de fotografie werd gebruikt..
- Op het gebied van reiniging en desinfectie wordt natriumbromide in combinatie met chloor gebruikt voor de sanering van grote hoeveelheden water, zoals in zwembaden en hot tubs..
Referenties
- Wikipedia. (s.f.). Natriumbromide. Opgehaald van en.wikipedia.org
- PubChem. (s.f.). Natriumbromide. Opgehaald van pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Uitnodiging voor organische chemie. Opgehaald van books.google.co.ve
- Science Direct. (s.f.). Natriumbromide. Opgehaald van sciencedirect.com
- Riviere, J. E. en Papich, M. G. (2009). Veterinaire farmacologie en therapeutica. Opgehaald van books.google.co.ve


Niemand heeft nog op dit artikel gereageerd.