
Butanonstructuur, eigenschappen en toepassingen
De butanon is een organische verbinding, in het bijzonder een keton, waarvan de chemische formule CH is3CHtweeAuto3. Het uiterlijk is dat van een kleurloze vloeistof die voornamelijk als oplosmiddel wordt gebruikt. Heeft eigenschappen die vergelijkbaar zijn met aceton, maar kookt bij hogere temperatuur en verdampt langzamer.
Het wordt geproduceerd door de katalytische dehydrogenering van 2-butanol (chirale verbinding). Het wordt echter in zijn natuurlijke staat aangetroffen in de samenstelling van sommige soorten fruit. Het maakt deel uit van de dampen van de uitlaatpijpen van voertuigen en is een bestanddeel van tabaksrook.
Het is na aceton de eenvoudigste van deze familie van organische verbindingen. Butanon veroorzaakt irritatie van de ogen en neus. Bij ongebruikelijk hoge doses kan het irritatie van het longslijmvlies veroorzaken. Aan de andere kant wordt deze vloeistof beschouwd als een precursor voor verdovende middelen..
Butanon heeft een grote oplosbaarheid in water; maar het is ook zeer oplosbaar in organische oplosmiddelen zoals ethanol, ether, aceton, benzeen en chloroform. Dit kan worden verklaard doordat uw log van P (0,29) -waarde voor de octaan / waterverdelingscoëfficiënt laag is.
Artikel index
- 1 Structuur van butanon
- 2 Eigenschappen
- 2.1 Moleculaire formule
- 2.2 Namen
- 2.3 Molaire massa
- 2.4 Fysieke beschrijving
- 2.5 Geur
- 2.6 Kookpunt
- 2.7 Smeltpunt
- 2.8 Vlampunt
- 2.9 Oplosbaarheid in water
- 2.10 Oplosbaarheid in organische oplosmiddelen
- 2.11 Dichtheid
- 2.12 Dampdichtheid
- 2.13 Dampspanning
- 2.14 Verdelingscoëfficiënt octanol / water
- 2.15 Zelfontbrandingstemperatuur
- 2.16 Ontleding
- 2.17 Viscositeit
- 2.18 Verbrandingswarmte
- 2.19 Verdampingswarmte
- 2.20 Oppervlaktespanning
- 2.21 Ionisatiepotentieel
- 2.22 Geurdrempelwaarde
- 2.23 Brekingsindex
- 2.24 Dissociatieconstante
- 2.25 Stabiliteit
- 3 toepassingen
- 3.1 Oplosmiddel
- 3.2 Reagens
- 3.3 Kunststof cement
- 3.4 Andere toepassingen
- 4 referenties
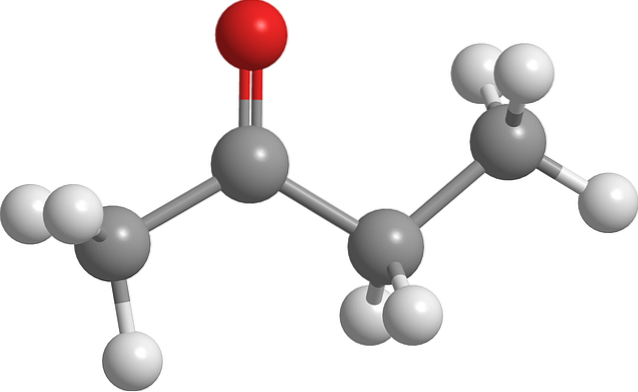
Structuur van butanon
De afbeelding hierboven toont het butanon-molecuul met een ball-and-stick-model. Het zuurstofatoom van de carbonylgroep (rode bol) is te zien op de tweede koolstof. Deze groep, C = O, is verantwoordelijk voor het geven van een permanent dipoolmoment aan het molecuul.
Butanon, structureel gezien, is niets meer dan een aceton waaraan een methyleengroep is toegevoegd, CHtwee. Omdat er meer koolstofatomen zijn, is het dipoolmoment kleiner in vergelijking met aceton; maar door zijn hogere moleculaire massa kookt het op een hogere temperatuur.
Dit molecuul mist, net als andere ketonen, het vermogen om waterstofbruggen te vormen; en daarom zijn hun dipool-dipool-interacties niet zo sterk.
Daarom is het een vluchtige vloeistof. Naarmate de temperatuur daalt (-86,6 ° C), zijn de zwakke dipolen degenen die de moleculen op een ordelijke manier oriënteren om een kristal te vormen. Daarnaast kan ook worden opgemerkt dat butanon structureel asymmetrisch is.
Eigendommen
Moleculaire formule
C4H.8O of CH3AutotweeCH3
Namen
- Butanon.
- 2-butanon.
- Butan-2-one.
- Methylethylketon.
Molaire massa
72,107 g / mol.
Fysieke beschrijving
Kleurloze vloeistof.
Geur
Muntgeurend, matig sterk.
Kookpunt
79,59 ° C bij 760 mmHg.
Smeltpunt
-86,6 ºC.
ontstekingspunt
-9 ºC (gesloten beker).
Oplosbaarheid in water
29 g / 100 ml bij 20 ° C. Hoewel het dipoolmoment minder is dan dat van aceton, kan het nog steeds in uitstekende mate interageren met watermoleculen. Van hen ontvangt het waterstofbruggen: (CH3) (CHtweeCH3) C = O-HOH. Hierdoor is het zeer goed oplosbaar in water.
Oplosbaarheid in organische oplosmiddelen
Oplosbaar in benzeen, alcohol en ether; Mengbaar met oliën, ethanol, ether, aceton, benzeen en chloroform. Merk op dat butanon oplosbaar is in een groot aantal verschillende oplosmiddelen.
Dichtheid
0,7997 g / cm3 bij 25 ºC.
Dampdichtheid
2,41 (ten opzichte van water = 1).
Dampdruk
90,6 mmHg bij 25 ºC.
Verdelingscoëfficiënt octanol / water
Log P = 0,29
Zelfontbranding temperatuur
505 ºC.
Ontleding
Het wordt afgebroken door fotochemische processen door oxidatie door vrije hydroxylradicalen, evenals door directe afbraak door fotolyse. Bij verhitting tot ontbinding geeft het scherpe rook af.
Viscositeit
0,40 cPoise bij 25 ° C.
Verbrandingswarmte
2.444,1 kJ / mol bij 25 ºC.
Warmte van verdamping
31,30 kJ / mol bij kookpunt; en 34,79 kJ / mol bij 25 ºC.
Oppervlaktespanning
23,97 mN / m bij 25 ºC.
Ionisatiepotentieel
0,54 eV.
Geurdrempel
Weinig geur: 0,735 mg / m3.
Sterke geur: 147,5 mg / m3.
Brekingsindex
1.788 bij 20 ºC.
Dissociatieconstante
pKa = 14,70.
Stabiliteit
Stabiel, maar licht ontvlambaar. Onverenigbaar met sterke oxidatiemiddelen, basen en reductiemiddelen. Vocht moet worden vermeden.
Toepassingen
Oplosmiddel
Butanon wordt gebruikt als oplosmiddel bij de vervaardiging van oppervlaktecoatings, bij de vervaardiging van rookloze poeders, bij de vervaardiging van gekleurde harsen en bij het verwijderen van vetophopingen geproduceerd door smeermiddelen.
Daarnaast wordt het gebruikt bij de uitwerking van:
- Kunstleer.
- Rubbers.
- Lakken.
- Vernissen.
- Lijmen.
- Oplosmiddelen.
- Verfverwijderaars.
- Lijmen.
- Plastic cementen.
- Afdichtingsmiddelen.
- Magnetische banden.
- Transparant papier.
- Drukinkten.
- Cosmetica en farmaceutische producten.
Het wordt ook gebruikt als oplosmiddel voor het ontvetten van metalen oppervlakken, reinigingsmiddelen voor elektronische apparatuur en vettextractie. Het wordt gebruikt voor de winning van hardhout en plantaardige olie.
Het is een inert ingrediënt bij de productie van pesticiden en bij de productie van celluloseacetaat en cellulosenitraat.
Het wordt gebruikt als extractieoplosmiddel bij de verwerking van voedsel en voedselingrediënten; bijvoorbeeld bij de fractionering van vetten en oliën, maar ook bij het cafeïnevrij maken van koffie. Wordt ook gebruikt als oplosmiddel in markers die op whiteboards worden gebruikt.
Reagens
- Butanon wordt gebruikt als een in water oplosbare foto-initiator voor de fotopolymerisatie van methacrylzuur..
- Het condenseert met formaldehyde om isopropenylketon te produceren.
- Ervaringen zelfcondensatie voor de productie van ethylamylketon.
- Reageert met citral om parfumcomponenten zoals methylpseudoionon te verkrijgen.
- Intervenieert als katalysator bij de productie van hydrazine.
- Bovendien is het een voorloper van methylethylketonperoxide, dat een katalysator is voor sommige polymerisatiereacties..
Kunststof cement
Butanon wordt toegepast als kunststof lasmiddel, onder meer bij de montage van piepschuim schaalmodellen. Het butanon lost het polystyreen op, waardoor de randen bij een nieuwe polymerisatie samenkomen. Dit gedrag is van cement en niet van lijm.
Andere gebruiken
Butanon wordt gebruikt als sterilisator voor bacteriële sporen in chirurgische instrumenten, naalden, onderhuidse injectoren en tandheelkundige instrumenten..
Het wordt in zeer lage concentraties gebruikt als smaakstof voor levensmiddelen; in alcoholische dranken is de concentratie bijvoorbeeld 20 ppm; in gebakken producten, 12,7 ppm; vlees heeft ongeveer 26,5 ppm; kauwgom, 0,63 dpm; en in vetten en oliën 1,0 dpm.
En tot slot wordt butanon gebruikt bij de scheiding van het apoproteïne van de heemgroep in de hemeproteïnen..
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5ta Editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10theditie.). Wiley plus.
- Nationaal centrum voor informatie over biotechnologie. (2019). Methylethylketon PubChem Database. CID = 6569. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Butanon. Hersteld van: en.wikipedia.org
- Royal Society of Chemistry. (2015). Butanon. Chemspider. Hersteld van: chemspider.com
- Arlem Cheprasov. (2019). Wat is butanon? Formule en gebruik. Studie. Hersteld van: study.com
- Vasler Ben. (17 mei 2017). Butanon. Chemistry World. Hersteld van: chemistryworld.com



Niemand heeft nog op dit artikel gereageerd.