
Warmte-geabsorbeerde formules, hoe deze te berekenen en opgeloste oefeningen
De geabsorbeerde warmte Het wordt gedefinieerd als de overdracht van energie tussen twee lichamen bij verschillende temperaturen. Degene met een lagere temperatuur absorbeert de warmte van degene met een hogere temperatuur. Wanneer dit gebeurt, neemt de thermische energie van de stof die warmte absorbeert toe, en de deeltjes waaruit het bestaat, trillen sneller, waardoor hun kinetische energie toeneemt..
Dit kan leiden tot een temperatuurstijging of een verandering in toestand. Ga bijvoorbeeld van vast naar vloeibaar, zoals ijs wanneer het smelt in contact met water of frisdrank bij kamertemperatuur.

Dankzij warmte is het ook mogelijk dat objecten van afmetingen veranderen. Thermische uitzetting is een goed voorbeeld van dit fenomeen. Wanneer de meeste stoffen worden verwarmd, ervaren ze meestal een toename in hun afmetingen.
Een uitzondering hierop is water. Dezelfde hoeveelheid vloeibaar water neemt toe als het afkoelt tot onder de 4 ºC. Bovendien kunnen temperatuurveranderingen ook veranderingen in de dichtheid ondergaan, iets wat ook erg waarneembaar is in het geval van water..
Artikel index
- 1 Waar het uit bestaat en formules
- 1.1 Calorieën
- 2 Hoe het te berekenen?
- 2.1 De energiebalans
- 3 Oefening opgelost
- 3.1 Aanpak
- 3.2 Gegevens
- 4 referenties
Waar het uit bestaat en formules
In het geval van energie die onderweg is, zijn de eenheden van geabsorbeerde warmte joules. Warmte had echter lange tijd zijn eigen eenheden: de calorie.
Zelfs vandaag de dag wordt deze eenheid gebruikt om de energie-inhoud van voedsel te kwantificeren, hoewel in werkelijkheid een dieetcalorie overeenkomt met een kilocalorie warmte.
Calorieën
De calorie, afgekort als limoen, is de hoeveelheid warmte die nodig is om de temperatuur van 1 gram water met 1 º C te verhogen.
In de 19e eeuw voerde Sir James Prescott Joule (1818 - 1889) een beroemd experiment uit waarbij hij erin slaagde mechanisch werk in warmte om te zetten, waarbij hij de volgende gelijkwaardigheid verkreeg:
1 calorie = 4,186 joule
In Britse eenheden wordt de warmte-eenheid Btu genoemd (Britse Warmte-eenheid), die wordt gedefinieerd als de hoeveelheid warmte die nodig is om de temperatuur van een pond water met 1 ºF te verhogen.
De gelijkwaardigheid tussen eenheden is als volgt:
1 Btu = 252 calorieën
Het probleem met deze oudere units is dat de hoeveelheid warmte afhankelijk is van de temperatuur. Dat wil zeggen, degene die nodig is om van 70 ° C naar 75 ° C te gaan, is niet dezelfde die nodig is om het water van bijvoorbeeld 9 ° C naar 10 ° C te verwarmen..
Dat is de reden waarom de definitie goed gedefinieerde bereiken overweegt: van 14,5 tot 15,5 ° C en 63 tot 64 ° F voor respectievelijk de calorie en Btu..
Waarvan hangt de hoeveelheid opgenomen warmte af?
De hoeveelheid warmte die een materiaal opneemt, is afhankelijk van verschillende factoren:
- Massa. Hoe groter de massa, hoe meer warmte het kan opnemen.
- Kenmerken van de stof. Er zijn stoffen die, afhankelijk van hun moleculaire of atomaire structuur, meer warmte kunnen opnemen dan andere..
- Temperatuur. Het toevoegen van meer warmte is vereist om een hogere temperatuur te verkrijgen.
De hoeveelheid warmte, aangeduid als Q, het is evenredig met de beschreven factoren. Daarom kan het worden geschreven als:
Q = m.c.ΔT
Waar m is de massa van het object, c is een constante oproep specifieke hitte, een intrinsieke eigenschap van de stof en ΔT is de temperatuurvariatie die wordt bereikt door warmte te absorberen.
ΔT = TF. - Tof
Dit verschil heeft een positief teken, aangezien dat bij het opnemen van warmte wordt verwacht TF. > T.of. Dit gebeurt tenzij de stof een faseverandering ondergaat, zoals water dat van vloeistof naar damp gaat. Als water kookt, blijft de temperatuur constant op ongeveer 100ºC, hoe snel het ook kookt..
Hoe het te berekenen?
Door twee objecten met verschillende temperaturen in contact te brengen, bereiken ze na verloop van tijd allebei een thermisch evenwicht. Dan worden de temperaturen gelijk en stopt de warmteoverdracht. Hetzelfde gebeurt als meer dan twee objecten met elkaar in contact komen. Na een bepaalde tijd hebben ze allemaal dezelfde temperatuur.
Ervan uitgaande dat de met elkaar in aanraking komende objecten een gesloten systeem vormen, waaruit warmte niet kan ontsnappen, is het principe van energiebesparing van toepassing, zodat kan worden gesteld dat:
Q geabsorbeerd = - Q opgeleverd
Dit vertegenwoordigt een energiebalans, vergelijkbaar met die van iemands inkomen en uitgaven. Om deze reden heeft de overgedragen warmte een negatief teken, omdat voor het object dat meegeeft, de eindtemperatuur lager is dan de oorspronkelijke temperatuur. Daarom:
ΔT = TF. - Tof < 0
De Q-vergelijking geabsorbeerd = - Q opgeleverd het wordt gebruikt wanneer twee objecten in contact zijn.
Energiebalans
Om de energiebalans uit te voeren, is het nodig om de objecten die warmte absorberen te onderscheiden van de objecten die afgeven, en dan:
Σ Qk= 0
Dat wil zeggen, de som van energiewinsten en -verliezen in een gesloten systeem moet gelijk zijn aan 0.
De soortelijke warmte van een stof
Om de hoeveelheid opgenomen warmte te berekenen, is het nodig om de soortelijke warmte van elke deelnemende stof te kennen. Dit is de hoeveelheid warmte die nodig is om de temperatuur van 1 g materiaal met 1 ° C te verhogen. De eenheden in het internationale systeem zijn: joule / kg. K.
Er zijn tabellen met de soortelijke warmte van veel stoffen, meestal berekend met een calorimeter of vergelijkbaar gereedschap..
Een voorbeeld van hoe je de soortelijke warmte van een materiaal kunt berekenen
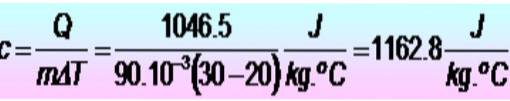
Er zijn 250 calorieën nodig om de temperatuur van een metalen ring van 20 naar 30 ºC te verhogen. Als de ring een massa heeft van 90 g. Wat is de soortelijke warmte van het metaal in SI-eenheden??
Oplossing
Eenheden worden eerst geconverteerd:
Q = 250 calorieën = 1046,5 J.
m = 90 g = 90 x 10-3 kg
Oefening opgelost
Een aluminium beker bevat 225 g water en een koperen roerstaafje van 40 g, allemaal op 27 ° C. Een monster van 400 g zilver met een begintemperatuur van 87 ° C wordt in het water geplaatst.
De roerder wordt gebruikt om het mengsel te roeren tot het zijn uiteindelijke evenwichtstemperatuur van 32 ° C bereikt. Bereken de massa van de aluminium beker, rekening houdend met het feit dat er geen warmteverliezen zijn naar de omgeving.
Nadering
Zoals hierboven vermeld, is het belangrijk om onderscheid te maken tussen objecten die warmte afgeven en objecten die:
- Aluminium beker, koperen roerder en water absorberen warmte.
- Zilvermonster levert warmte op.
Gegevens
De specifieke heats van elke stof worden geleverd:
- Zilver: c = 234 J / kg. ºC
- Koper: c = 387 J / kg. ºC
- Aluminium c = 900 J / kg. ºC
- Water c = 4186 J / kg. ºC
De warmte die door elke stof wordt opgenomen of overgedragen, wordt berekend met behulp van de vergelijking:
Q = m.c.λT
Oplossing
Zilver
Q opgeleverd = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Koperen roerder
Q geabsorbeerd = 40 x 10 -3 . 387 x (32 - 27) J = 77,4 J
Water
Q geabsorbeerd = 225 x 10 -3 . 4186 x (32 - 27) J = 4709,25 J
Aluminium mok
Q geabsorbeerd = m aluminium . 900 x (32 - 27) J = 4500 .m aluminium
Gebruik maken van:
Σ Qk= 0
77,4 + 4709,25 + 4500 .m aluminium = - (-5148)
Ten slotte wordt de massa van het aluminium gewist:
m aluminium = 0,0803 kg = 80,3 g
Referenties
- Giancoli, D. 2006. Natuurkunde: principes met toepassingen. 6th. Ed Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Natuurkunde: een blik op de wereld. 6ta Verkorte editie. Cengage leren. 156 - 164.
- Rex, A. 2011. Fundamentals of Physics. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitaire natuurkunde met moderne natuurkunde. 14th. Deel 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9na Cengage leren. 362 - 374


Niemand heeft nog op dit artikel gereageerd.