
Eigenschappen, risico's en toepassingen van arseenzuur (H3AsO3)
De arseenzuur het is een anorganische verbinding met formule H3AsO3. De structuur is analoog aan trihydroxyamine en kan worden herschreven als As (OH) 3. Het is in waterige vorm en het was niet mogelijk om het in zuivere vaste toestand te isoleren. De structuur is weergegeven in figuur 1.
De uitwerking van As (OH) 3 brengt een langzame hydrolyse van arseentrioxide in water met zich mee. De som van de base zet het arseenzuur om in de arsenietionen: [AsO (OH) 2] -, [AsO2 (OH)] 2- en [AsO3] 3-.
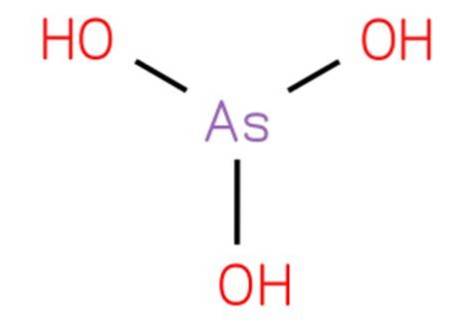
Het is een zwak zuur. Reacties die worden toegeschreven aan waterig arseentrioxide zijn te wijten aan arseenzuur en zijn geconjugeerde basen.
Artikel index
- 1 Fysische en chemische eigenschappen van arseenzuur
- 2 Reactiviteit en gevaren
- 2.1 In geval van contact met de ogen
- 2.2 Bij huidcontact
- 2.3 Bij inslikken
- 2.4 Bij inademing
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen van arseenzuur
Arseenzuur is een piramidaal molecuul dat bestaat uit drie hydroxylgroepen die aan arseen zijn gehecht. Het 1H NMR-spectrum van arseenzuuroplossingen bestaat uit een enkel signaal dat consistent is met de hoge symmetrie van het molecuul. Bestaat alleen in waterige oplossing.
Deze oplossing is kleurloos en heeft geen karakteristiek aroma. Het wordt opgeslagen in amberkleurige containers om reactie met UV-straling te voorkomen (National Center for Biotechnology Information, 2017).

Het molecuulgewicht is 125,94 g / mol. Hoewel de verbinding niet is geïsoleerd, zijn de eigenschappen ervan berekend met behulp van computationele methoden (© Royal Society of Chemistry, 2015) waarbij werd verkregen dat het een smeltpunt van 271,52 ° C, een kookpunt van 626,14 ° C en een oplosbaarheid in water van 1 x 106 mg / l bij 25 ° C.
De verbinding heeft een pKa van 9,2 voor de reactie:
H3AsO3 ⇌ H2AsO3- + H+
De literatuur vermeldt dat de verbinding een amfoteer karakter heeft, hoewel het als base in mindere mate dissocieert dan als een zuur, waarbij de base een pKb van 14 heeft voor de reactie:
Als (OH) 3 ⇌ Als (OH) 2+ + OH-
Dit leidt tot de vorming van soorten zoals zure arseenhydroxidesulfaten (As (OH) (HSO4) +, As (OH) 2 (HSO4)) in geconcentreerde oplossingen van zwavelzuur of tot de vorming van arseenzuursulfaat (As (HSO4) ) 3) in rokende zwavelzuuroplossingen.
Arseenzuur kan werken als een oxidatiemiddel of een reductiemiddel en blijft als elementair arseen of arseenzuur respectievelijk volgens de halfreacties:
H3AsO3 + 3H + + 3e- → As + 3 H2O (ξ0 = +0,240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
Arseenzuur is een sterker oxidatiemiddel dan zijn fosfonzuur-tegenhanger, maar een zwakker reductiemiddel dan het (Egon Wiberg, 2001).
Reactiviteit en gevaren
Arseenzuur is een verbinding die als stabiel is geclassificeerd, maar het is een giftig en bijtend reagens.
De verbinding heeft een verwaarloosbaar brand- en explosiegevaar bij blootstelling aan hitte of vlammen. In dit geval moet de container indien mogelijk worden verplaatst, vermijd inademing van dampen of stof..
Bij verhitting geeft de verbinding giftige en corrosieve arseenoxidedampen af. Onafhankelijke ademhalingsapparatuur en beschermende kleding moeten worden gedragen om contact in geval van brand te vermijden.
Het kan irriterend zijn voor de ogen, huid en slijmvliezen. Kan overgevoeligheid veroorzaken. Vergiftiging kan het centrale zenuwstelsel, het maagdarmstelsel en het cardiovasculaire systeem, de lever en de nieren aantasten. Verbindingen die arseen bevatten, zijn zeer giftig en kankerverwekkend.
In geval van contact met de ogen
Met veel water spoelen gedurende tenminste 15 minuten, af en toe de oogleden optillen totdat er geen sporen meer zijn van chemische residuen.
Bij huidcontact
Onmiddellijk met veel water en zeep wassen gedurende tenminste 15 minuten, terwijl verontreinigde kleding en schoenen worden verwijderd. Brandwonden zijn bedekt met een droog steriel verband (veilig, niet strak).
Bij inslikken
Om het zuur te verdunnen, moet het slachtoffer bij bewustzijn grote hoeveelheden water krijgen. Gebruik geen maagspoeling en wek geen braken op. Medisch personeel moet de luchtwegen en ademhaling in stand houden.
Bij inademing
Indien nodig moet kunstmatige beademing worden gegeven. Verplaats het slachtoffer naar een koele plaats en blijf warm en rustig.
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (Material Safety Data Sheet Arsenious acid solution, 2007).
Toepassingen
Arseenzuur wordt gebruikt om kleine hoeveelheden jodium of jodiumverbindingen te detecteren. In het werk van (Weegh, 1972) werden enkele aspecten van de ceriumreactie van arseenzuur bestudeerd, waarbij aandacht werd besteed aan de optische eigenschappen van ceriumoplossingen..
Ook zijn de kinetische effecten van verschillende verbindingen bestudeerd, met name de effecten van chloride- en bromide-ionen en de kinetische effecten van chloride of bromide in combinatie met jodide..
Arseenzuur kan ook illegaal worden gebruikt om abortussen te veroorzaken (Trend, 1858).
Arseenzuur reageert bij verhitting en vormt arseentrioxide (As2O3). Deze verbinding is ook algemeen bekend onder de naam arseenzuur, ondanks dat het niet dezelfde verbinding is. De structuur van arseentrioxide wordt weergegeven in figuur 3.
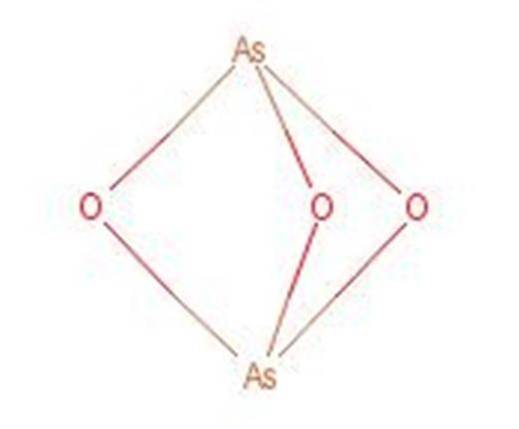
Figuur 1: structuur van arseentrioxide.
Deze verbinding, ook bekend als Trisenox, wordt gebruikt om leukemiepatiënten te behandelen die niet op andere middelen hebben gereageerd. Dit medicijn is goedgekeurd voor gebruik door de Amerikaanse Food and Drug Administration (FDA) als behandeling voor leukemie..
Hoe de verbinding werkt, is onduidelijk. Het kan morfologische veranderingen en DNA-fragmentatie veroorzaken in promyelocytische leukemiecellen, met celdood en afbraak of beschadiging van PML / RAR-alfa (een fusie-eiwit) tot gevolg (Nurse's Drug Handbook 7e editie, 2013).
Omdat het giftig is voor het menselijk lichaam, is het een van de zeer discutabele medicijnen in het veld. Arseentrioxide werd voor het eerst gebruikt als een traditioneel Chinees medicijn genaamd Pi Shuang. Het wordt nog steeds gebruikt om kankerpatiënten en andere gezondheidsproblemen te behandelen. (Arsenious acid review, 2007-2016).
Referenties
- © Royal Society of Chemistry. (2015). Arseenzuur. Hersteld van chemspider.
- © Royal Society of Chemistry. (2015). Trihydroxyamine. Hersteld van chemspider.
- Arsenious acid review. (2007-2016). Hersteld van medisch boek.
- Arseenzuur. (2014, 28 juli). Hersteld van ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Anorganische scheikunde. Berlijn: academische pers.
- Veiligheidsinformatieblad Arseniumzuuroplossing. (2007, 10 september). Hersteld van t3db.ca.
- Nationaal centrum voor informatie over biotechnologie. (2017, 4 maart). PubChem samengestelde database; CID = 545,. Opgehaald van PubChem.
- Nurse's Drug Handbook 7e druk (2013). McGraw-Hill.
- Trend, H. G. (1858). Een geval waarin arseniumzuur werd gebruikt om abortus te bewerkstelligen. originele communicatie van het Britse medische tijdschrift, 725-726.
- Weegh, W. H. (1972). Het gebruik van de cerine-arseenzuurreactie voor de bepaling van kleine hoeveelheden jodium of jodiumverbindingen. Clinica Chimica Acta Volume 39, Issue 2, 327-338.


Niemand heeft nog op dit artikel gereageerd.