
Kaliumcarbonaat (K2CO3) structuur, eigenschappen, gebruik, productie

De Kaliumcarbonaat is een anorganische verbinding die wordt gevormd door twee kalium-K-ionen+ en een carbonaat-ion CO3twee-. De chemische formule is KtweeCO3. Het is een hygroscopische witte vaste stof, dat wil zeggen dat het gemakkelijk water uit de omgeving opneemt. Om deze reden wordt het in laboratoria gebruikt om water uit andere stoffen op te nemen..
Het is zeer oplosbaar in water en vormt alkalische oplossingen die rijk zijn aan OH-ionen.-en dus met een hoge pH-waarde. De waterige oplossingen, die alkalisch zijn, worden in verschillende industriële processen gebruikt om zure gassen zoals kooldioxide CO te absorberentwee en waterstofsulfide HtweeJa, het neutraliseert ze gemakkelijk.

De K.tweeCO3 Het wordt gebruikt om zeep, schoonmaakproducten, wasmiddelen en afwasmixen te bereiden. Het wordt ook gebruikt bij de verwerking van sommige textielvezels zoals wol..
Het wordt veel gebruikt in chemielaboratoria, bijvoorbeeld om water uit andere verbindingen te absorberen of om mengsels van chemische reacties te alkaliseren en ook bij chemische analyse.
Het wordt ook aan sommige voedingsmiddelen toegevoegd, bijvoorbeeld om de bittere smaak van cacaobonen tijdens de productie van chocolade te elimineren..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3,7 pH
- 3.8 Chemische eigenschappen
- 4 Verkrijgen
- 5 toepassingen
- 5.1 Bij de opname van CO2 in industriële processen
- 5.2 Bij het verwijderen van H2S uit bepaalde processen
- 5.3 In scheikundige laboratoria
- 5.4 In de schoonmaakproductenindustrie
- 5.5 In de voedingsindustrie
- 5.6 In meststoffen
- 5.7 In verschillende toepassingen
- 6 referenties
Structuur
Kaliumcarbonaat bestaat uit twee kalium-K-kationen+ en een carbonaatanion CO3twee-. Het carbonaatanion heeft een platte en symmetrische structuur, terwijl de drie zuurstofatomen de koolstof omringen en een platte driehoek vormen..
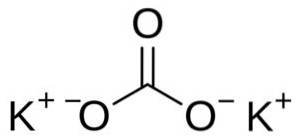
Nomenclatuur
- Kaliumcarbonaat
- Kaliumcarbonaat
- Dikaliumcarbonaat
- Potas
- Kaliumzout van koolzuur.
Eigendommen
Fysieke toestand
Kleurloze tot witte kristallijne vaste stof.
Molecuulgewicht
138,205 g / mol.
Smeltpunt
899 ºC.
Kookpunt
Het valt uiteen.
Dichtheid
2,29 g / cm3
Oplosbaarheid
Zeer oplosbaar in water: 111 g / 100 g water bij 25 ° C. Onoplosbaar in ethanol en aceton.
pH
Een waterige oplossing kan een pH van 11,6 hebben, dat wil zeggen dat deze vrij alkalisch is.
Chemische eigenschappen
Kaliumcarbonaat is vervloeiend of hygroscopisch, dat wil zeggen dat het vocht uit de omgeving absorbeert. Het heeft een stabiel hydraat, KtweeCO3.2HtweeOF.
De K.tweeCO3 in waterige oplossing hydrolyseert het, dat wil zeggen, het reageert met water, waardoor OH-groepen vrijkomen- welke zijn degenen die alkaliteit aan de oplossingen geven:
CO3twee- + H.tweeO ⇔ OH- + HCO3-
HCO3- + H.tweeO ⇔ OH- + H.tweeCO3
Het verkrijgen van
Het kan worden verkregen uit de as die overblijft bij het verbranden van planten. Ook door carbonatatie van kaliumhydroxide KOH, dat wil zeggen het toevoegen van overtollig koolstofdioxide COtwee aan KOH:
KOH + COtwee → KHCO3
2 KHCO3 + warmte → KtweeCO3 + H.tweeOF
Een andere manier om het te verkrijgen is door kaliumchloride KCl te verwarmen met magnesiumcarbonaat MgCO3, water en COtwee onder druk. Een gehydrateerd dubbelzout van magnesium en kalium wordt eerst MgCO verkregen3.KHCO3.4HtweeOf, Engels-zout genoemd:
2 KCl + 3 MgCO3 + COtwee + 5 uurtweeO → MgCO3.KHCO3.4HtweeO ↓ + MgCltwee
Het gehydrateerde dubbelzout van Engels slaat neer en wordt uit de oplossing gefilterd. Vervolgens wordt het verwarmd en wordt het kaliumcarbonaat K gevormdtweeCO3 dat bij het toevoegen van water oplost terwijl magnesiumcarbonaat MgCO3 blijft onoplosbaar en wordt verwijderd door filtratie.
MgCO3.KHCO3.4HtweeO + warmte → MgCO3↓ + 2K+ + CO3twee- + COtwee↑ + 9 HtweeOF
Toepassingen
Bij de opname van COtwee in industriële processen
De kaliumcarbonaatoplossing is de klassieke behandeling voor het verwijderen van kooldioxide COtwee in verschillende processen, vooral in hogedruk- en hogetemperatuur-toepassingen.

CO-verwijderingtwee gebeurt volgens de volgende reactie:
KtweeCO3 + COtwee + H.tweeO ⇔ 2 KHCO3
Deze methode wordt bijvoorbeeld gebruikt om aardgas te behandelen. Ook in elektriciteitscentrales, om de uitstoot van CO te vermijdentwee in de atmosfeer en bij de productie van droogijs.

K's oplossingtweeCO3 kan thermisch worden geregenereerd, dat wil zeggen door verhitting tot temperaturen rond 100 ° C.
Om ervoor te zorgen dat de kaliumcarbonaatoplossing de CO2 met een goede snelheid kan opnemen, worden promotors toegevoegd die het proces versnellen zoals diethanolamine (DEA)..
Bij het verwijderen van HtweeS van bepaalde processen
Kaliumcarbonaatoplossingen worden ook gebruikt om waterstofsulfidegas H te verwijderentweeS voor processtromen. Kalium-K-trifosfaat wordt soms toegevoegd3PO4 om het proces sneller te maken.
In scheikundelaboratoria
De K.tweeCO3 Het maakt het mogelijk om organische syntheses uit te voeren, bijvoorbeeld in condensatiereacties en om te neutraliseren. Het wordt gebruikt om water uit organische vloeistoffen te verwijderen, als dehydratatiemiddel of als droogmiddel in het laboratorium.
Het wordt ook gebruikt in analytische chemische reacties en voor alkalisatie in de farmaceutische industrie..
In de schoonmaakproductenindustrie
De K.tweeCO3 Het wordt gebruikt om zeep, reinigingsformules, was- en afwasproducten te maken, en ook om shampoo en andere producten voor persoonlijke verzorging te bereiden.

In de voedingsindustrie
Kaliumcarbonaat wordt voor verschillende doeleinden aan verschillende voedingsmiddelen toegevoegd.
Het wordt bijvoorbeeld toegevoegd aan cacaobonen om hun bittere smaak te verwijderen en ze te gebruiken bij de productie van chocolade. Het wordt tijdens het droogproces aan de druiven toegevoegd om rozijnen te verkrijgen.

In gebak wordt het gebruikt als rijsmiddel (dat fungeert als gist) voor meel om gebakken goederen te bereiden..

In meststoffen
De K.tweeCO3 Het wordt gebruikt om zure bodems te bemesten, aangezien het carbonaat-ion CO3twee- in contact met water produceert OH-ionen- die de pH van de grond verhogen. Plus kalium K+ het is een voedingsstof voor planten.
Kaliumcarbonaat is ook gebruikt om meststoffen met langzame afgifte te maken.
Een meststof met langzame afgifte geeft voedingsstoffen langzaam af of vrij, zodat ze niet worden opgelost en weggespoeld. Hierdoor kunnen ze meer tijd besteden aan de wortels van de plant.
In verschillende toepassingen
Kaliumcarbonaat KtweeCO3 het wordt ook gebruikt om:
- Processen voor het verven, bleken en reinigen van ruwe wol en andere activiteiten van de textielindustrie
- Het verkrijgen van andere organische en anorganische kaliumzouten, zoals KCN-kaliumcyanide.
- Functioneren als zuurteregelaar in verschillende processen.
- Keramiek en aardewerk maken.
- Gravure en lithografieprocessen.
- Looien en afwerken van leer.
- Bereid inkten voor op afdrukken, pigmenten.
- Fabricage van brillen speciaal voor televisie, sinds de KtweeCO3 is meer compatibel dan natriumcarbonaat NatweeCO3 met lood-, barium- en strontiumoxiden in deze glazen.
- Water behandeling.
- Brandvertragend (in de vorm van waterige oplossingen).
- Corrosie tegengaan en als aangroeiwerend middel in procesapparatuur.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Kaliumcarbonaat. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Steele, D. (1966). De chemie van de metalen elementen. Pergamon Press Ltd. Londen.
- Mokhatab, S. et al. (2019). Aardgasbehandeling. De kaliumcarbonaatoplossing. In Handbook of Natural Gas Transmission and Processing (vierde editie). Opgehaald van sciencedirect.com.
- Kakaras, E. et al. (2012). Gecombineerde cyclussystemen met wervelbedverbranding onder druk (PFBC). Verbranding van wervelbed onder druk met opvang en opslag van koolstof. In gecombineerde cyclussystemen voor energieopwekking met bijna nulemissie. Opgehaald van sciencedirect.com.
- Speight, J.G. (2019). Waterstofproductie. Nat schrobben. Bij zware oliewinning en -upgrades. Opgehaald van sciencedirect.com.
- Branan, C.R. (2005). Gasbehandeling: hoofdstuk bijgewerkt door Chris Higman. Heet carbonaatprocessen. In Rules of Thumb for Chemical Engineers (vierde editie). Opgehaald van sciencedirect.com.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Vierde druk. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Vijfde editie. VCH Verlagsgesellschaft mbH.
- Li, Y. en Cheng, F. (2016). Synthese van een nieuwe kaliummeststof met langzame afgifte uit gemodificeerde Pidgeon-magnesiumslak door kaliumcarbonaat. J Air Waste Manag Assoc, aug. 2016; 66 (8): 758-67. Opgehaald van ncbi.nlm.nih.gov.

Niemand heeft nog op dit artikel gereageerd.