
Koolstofeigenschappen, structuur, verkrijgen, gebruik
De koolstof Het is een niet-metallisch chemisch element waarvan het chemische symbool C is. Het dankt zijn naam aan steenkool, plantaardig of mineraal, waar zijn atomen verschillende structuren definiëren. Veel auteurs kwalificeren het als de koning van de elementen, omdat het een breed scala aan organische en anorganische verbindingen vormt en ook voorkomt in een aanzienlijk aantal allotropen..
En als dit niet genoeg is om ernaar te verwijzen als een speciaal element, wordt het in alle levende wezens aangetroffen; al zijn biomoleculen danken hun bestaan aan de stabiliteit en sterkte van de CC-bindingen en hun sterke neiging tot aaneenschakeling. Koolstof is het element van leven, en met zijn atomen zijn hun lichamen gebouwd.

De organische verbindingen waarmee biomaterialen worden gebouwd, bestaan praktisch uit koolstofskeletten en heteroatomen. Deze zijn met het blote oog te zien in het bos van de bomen; en ook, wanneer de bliksem hen treft en ze roostert. De resterende inerte zwarte vaste stof heeft ook koolstof; maar het gaat over houtskool.
Er zijn dus "dode" manifestaties van dit element: houtskool, een verbrandingsproduct in zuurstofarme omgevingen; en minerale steenkool, een product van geologische processen. Beide vaste stoffen lijken op elkaar, ze zijn zwart en ze branden om warmte en energie op te wekken; hoewel met verschillende opbrengsten.
Vanaf dit punt is koolstof het 15e meest voorkomende element in de aardkorst. Geen wonder dat er jaarlijks miljoenen tonnen steenkool worden geproduceerd. Deze mineralen verschillen in hun eigenschappen afhankelijk van de mate van onzuiverheden, waardoor antraciet de hoogste kwaliteit minerale steenkool is..
De aardkorst is niet alleen rijk aan minerale steenkool, maar ook aan carbonaten, vooral kalksteen en dolomiet. En wat het heelal betreft, het is het vierde meest voorkomende element; Ik bedoel, er is daarbuiten meer koolstof op andere planeten.
Artikel index
- 1 Geschiedenis van koolstof
- 1.1 Terugkijken
- 1.2 Erkenning
- 2 Eigenschappen
- 2.1 Grafiet versus diamant
- 3 Structuur en elektronische configuratie
- 3.1 Hybridisaties
- 3.2 oxidatienummers
- 3.3 Moleculaire geometrieën
- 3.4 Amorfe of kristallijne vaste stoffen
- 4 Verkrijgen
- 5 toepassingen
- 6 Risico's en voorzorgsmaatregelen
- 7 referenties
Carbon geschiedenis
Terugblik
Koolstof kan zo oud zijn als de aardkorst zelf. Sinds onheuglijke tijden zijn oude beschavingen dit element tegengekomen in zijn vele natuurlijke presentaties: roet, houtskool, houtskool, houtskool, diamanten, grafiet, koolteer, antraciet, enz..
Al die vaste stoffen, hoewel ze de donkere tinten deelden (met uitzondering van diamant), verschilden de rest van hun fysieke eigenschappen, evenals hun samenstelling, opmerkelijk. Destijds was het onmogelijk om te beweren dat ze in wezen uit koolstofatomen bestonden.
Zo werd steenkool door de geschiedenis heen geclassificeerd op basis van de kwaliteit bij verbranding en het leveren van warmte. En met de gassen die werden gevormd door de verbranding, werden massa's water verwarmd, die op hun beurt dampen produceerden die turbines bewogen die elektrische stromen opwekten..
Koolstof was onverwacht aanwezig in houtskool dat werd geproduceerd door bomen te verbranden in gesloten of hermetische ruimtes; in het grafiet waarmee de potloden zijn gemaakt; in diamanten die als edelstenen worden gebruikt; was verantwoordelijk voor de hardheid van het staal.
Haar geschiedenis gaat hand in hand met hout, buskruit, gassen voor stadsverlichting, treinen en schepen, bier, smeermiddelen en andere essentiële voorwerpen voor de vooruitgang van de mensheid..
Herkenning
Op welk punt waren wetenschappers in staat om de allotropen en mineralen van koolstof aan hetzelfde element te koppelen? Steenkool werd gezien als een mineraal, en het werd niet beschouwd als een chemisch element dat het periodiek systeem waardig was. De eerste stap had moeten zijn om aan te tonen dat al deze vaste stoffen werden omgezet in hetzelfde gas: kooldioxide, COtwee.
Antoine Lavoisier richtte in 1772 met behulp van een houten montuur met grote lenzen de zonnestralen op houtskoolmonsters en een diamant. Hij ontdekte dat geen van beide waterdampen vormde, maar COtwee. Hij deed hetzelfde met het roet en kreeg dezelfde resultaten..
Carl Wilhelm Scheele vond in 1779 de chemische relatie tussen houtskool en grafiet; dat wil zeggen, beide vaste stoffen waren samengesteld uit dezelfde atomen.
Smithson Tennant en William Hyde Wollaston bevestigden in 1797 methodologisch (door reacties) dat diamant inderdaad uit koolstof bestond door CO te producerentwee bij zijn verbranding.
Met deze resultaten werd al snel licht geworpen op grafiet en diamant, vaste stoffen gevormd door koolstof en daarom van hoge zuiverheid; in tegenstelling tot de onzuivere vaste stoffen van steenkool en andere koolstofhoudende mineralen.
Eigendommen
De fysische of chemische eigenschappen in vaste stoffen, mineralen of koolstofhoudende materialen zijn onderhevig aan vele variabelen. Onder hen zijn: de samenstelling of mate van onzuiverheden, de hybridisaties van de koolstofatomen, de diversiteit van de structuren en de morfologie of grootte van de poriën..
Wanneer de eigenschappen van koolstof worden beschreven, zijn de meeste teksten of bibliografische bronnen gebaseerd op grafiet en diamant..
Waarom? Omdat ze de bekendste allotropen voor dit element zijn en zeer zuivere vaste stoffen of materialen vertegenwoordigen; dat wil zeggen, ze zijn praktisch gemaakt van niets meer dan koolstofatomen (hoewel met verschillende structuren, zoals zal worden uitgelegd in de volgende sectie).
De eigenschappen van houtskool en minerale houtskool verschillen respectievelijk in hun oorsprong of samenstelling. Zo kruipt bruinkool (koolstofarm) als brandstof in vergelijking met antraciet (koolstofarm). En hoe zit het met de andere allotropen: nanotubes, fullerenen, grafenen, graffins, etc..
Chemisch hebben ze echter één punt gemeen: ze oxideren met een overmaat aan zuurstof in COtwee
C + OFtwee => COtwee
Nu is de snelheid of temperatuur die ze nodig hebben om te oxideren specifiek voor elk van deze allotropen..
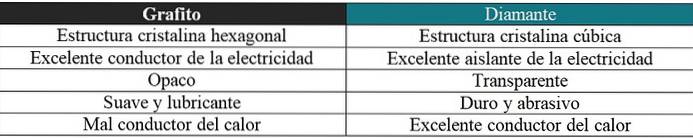
Grafiet versus diamant
Er zal hier ook een korte opmerking worden gemaakt met betrekking tot de zeer verschillende eigenschappen van deze twee allotropen:
Structuur en elektronische configuratie
Hybridisaties
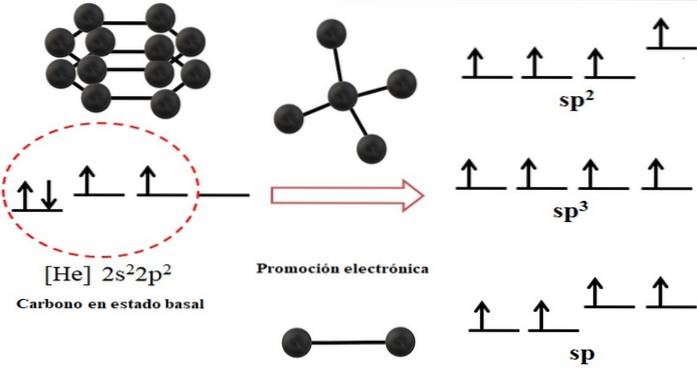
De elektronenconfiguratie voor het koolstofatoom is 1stwee2 sectwee2 Blztwee, ook geschreven als [He] 2stwee2 Blztwee (bovenste afbeelding). Deze weergave komt overeen met zijn grondtoestand: het koolstofatoom geïsoleerd en gesuspendeerd in een zodanig vacuüm dat het geen interactie kan aangaan met anderen..
Men kan zien dat een van zijn 2p-orbitalen elektronen mist, die een elektron uit de 2s-orbitaal met lagere energie accepteert door middel van elektronische promotie; en dus verwerft het atoom het vermogen om tot vier covalente bindingen te vormen via zijn vier sp hybride orbitalen3.
Merk op dat de vier sp-orbitalen3 ze zijn gedegenereerd in energie (uitgelijnd op hetzelfde niveau). Orbitalen p puur zijn energieker, daarom staan ze boven de andere hybride orbitalen (aan de rechterkant van de afbeelding).
Als er drie hybride orbitalen zijn, komt dat doordat er één orbitaal overblijft p zonder te kruisen; daarom zijn het drie sp-orbitalentwee. En als er twee van deze hybride orbitalen zijn, twee orbitalen p zijn beschikbaar om dubbele of drievoudige bindingen te vormen, zijnde de sp-koolstofhybridisatie.
Dergelijke elektronische aspecten zijn essentieel om te begrijpen waarom koolstof in oneindig veel allotropen kan worden gevonden..
Oxidatienummers
Voordat we verder gaan met de structuren, is het de moeite waard om te vermelden dat, gezien de valentie-elektronenconfiguratie 2stwee2 Blztwee, koolstof kan de volgende oxidatienummers hebben: +4, +2, 0, -2 en -4.
Waarom? Deze cijfers komen overeen met de aanname dat er een ionische binding bestaat, zodat u de ionen vormt met de respectievelijke ladingen; dat wil zeggen, C4+, Ctwee+, C0 (neutraal), Ctwee- en C4-.
Om koolstof een positief oxidatiegetal te geven, moet het elektronen verliezen; en om dit te doen, moet het noodzakelijkerwijs worden gebonden aan zeer elektronegatieve atomen (zoals zuurstof).
Ondertussen moet koolstof om een negatief oxidatiegetal te hebben, elektronen winnen door zich te binden aan metaalatomen of minder elektronegatief dan het (zoals waterstof).
Het eerste oxidatiegetal, +4, betekent dat de koolstof alle valentie-elektronen heeft verloren; de 2s en 2p orbitalen blijven leeg. Als de 2p-orbitaal zijn twee elektronen verliest, heeft de koolstof een oxidatiegetal van +2; als je twee elektronen krijgt, heb je -2; en als je nog twee elektronen krijgt door je valentie-octet te voltooien, -4.
Voorbeelden
Bijvoorbeeld voor COtwee het oxidatiegetal van koolstof is +4 (omdat zuurstof meer elektronegatief is); terwijl voor de CH4, is -4 (omdat waterstof minder elektronegatief is).
Voor de CH3OH, het oxidatiegetal van koolstof is -2 (+1 voor H en -2 voor O); terwijl het voor HCOOH +2 is (controleer of de som 0 oplevert).
Andere oxidatietoestanden, zoals -3 en +3, zijn ook waarschijnlijk, vooral als het gaat om organische moleculen; bijvoorbeeld in de methylgroepen, -CH3.
Moleculaire geometrieën
De bovenste afbeelding toonde niet alleen de hybridisatie van de orbitalen voor het koolstofatoom, maar ook de resulterende moleculaire geometrieën wanneer verschillende atomen (zwarte bollen) werden gekoppeld aan een centrale. Om een specifieke geometrische omgeving in de ruimte te hebben, moet dit centrale atoom de respectievelijke chemische hybridisatie hebben die dit mogelijk maakt..
Voor de tetraëder heeft de centrale koolstof bijvoorbeeld sp-hybridisatie3omdat dat de meest stabiele opstelling is voor de vier sp-hybride orbitalen3. In het geval van sp-koolstofatomentwee, ze kunnen dubbele bindingen vormen en hebben een trigonale omgeving; en dus definiëren deze driehoeken een perfecte zeshoek. En voor een sp-hybridisatie nemen de koolstofatomen een lineaire geometrie aan.
De geometrieën die worden waargenomen in de structuren van alle allotropen worden dus eenvoudig beheerst in tetraëders (sp3), zeshoeken of vijfhoeken (sptwee), en lijnen (sp).
Tetraëders definiëren een 3D-structuur, terwijl zeshoeken, vijfhoeken en lijnen, 3D- of 2D-structuren; De laatste worden de vlakken of platen die lijken op de wanden van de honingraten:

En als we deze zeshoekige wand (vijfhoekig of gemengd) vouwen, krijgen we een buis (nanobuisjes) of een bal (fullerenen), of een ander figuur. De interacties tussen deze figuren leiden tot verschillende morfologieën.
Amorfe of kristallijne vaste stoffen
Afgezien van de geometrieën, hybridisaties of morfologieën van de mogelijke structuren van koolstof, kunnen de vaste stoffen globaal worden ingedeeld in twee typen: amorf of kristallijn. En tussen deze twee classificaties zijn hun allotropen verdeeld.
Amorfe koolstof is gewoon een koolstof die een willekeurig mengsel van tetraëders, zeshoeken of lijnen vertoont, niet in staat om een structureel patroon vast te stellen; dat is het geval bij kolen, houtskool of actieve kool, cokes, roet enz..
Terwijl de kristallijne koolstof bestaat uit structurele patronen gevormd door een van de voorgestelde geometrieën; bijvoorbeeld diamant (driedimensionaal netwerk van tetraëders) en grafiet (gestapelde zeshoekige platen).
Het verkrijgen van
Koolstof kan zo zuiver zijn als grafiet of diamant. Deze zijn te vinden in hun respectievelijke mineralogische afzettingen, verspreid over de hele wereld en in verschillende landen. Daarom zijn sommige landen meer exporteurs van een van deze mineralen dan andere. Kortom, "je moet de aarde graven" om koolstof te krijgen.
Hetzelfde geldt voor minerale steenkool en zijn soorten. Maar dit is niet het geval met houtskool, aangezien een lichaam dat rijk is aan koolstof eerst moet ‘vergaan’, hetzij onder vuur, hetzij door elektrische blikseminslag; natuurlijk, bij afwezigheid van zuurstof, anders komt er CO vrijtwee.
Een heel bos is een koolstofbron zoals houtskool; niet alleen vanwege de bomen, maar ook vanwege de fauna.
In het algemeen moeten monsters die koolstof bevatten een pyrolyse ondergaan (verbranding in afwezigheid van zuurstof) om een deel van de onzuiverheden als gassen vrij te maken; en dus blijft er een vaste stof die rijk is aan koolstof (amorf of kristallijn) als residu achter.
Toepassingen
Nogmaals, net als de eigenschappen en structuur, zijn de toepassingen of toepassingen consistent met de allotropen of mineralogische vormen van koolstof. Naast enkele bekende punten zijn er echter bepaalde algemeenheden die kunnen worden genoemd. Dat zijn:
-Koolstof wordt al lang gebruikt als mineraal reductiemiddel om zuivere metalen te verkrijgen; bijvoorbeeld ijzer, silicium en fosfor.
-Het is de hoeksteen van het leven, en organische chemie en biochemie zijn de studies van deze reflectie..
-Het is ook een fossiele brandstof geweest waardoor de eerste machines hun versnellingen konden draaien. Evenzo werd er koolstofgas uit gewonnen voor de oude verlichtingssystemen. Steenkool stond synoniem voor licht, warmte en energie.
-Als additief gemengd met ijzer in verschillende verhoudingen, maakte het de uitvinding en verbetering van staalsoorten mogelijk.
-De zwarte kleur vond plaats in de kunst, vooral grafiet en alle geschriften die met zijn slagen werden gemaakt..
Risico's en voorzorgsmaatregelen
Koolstof en zijn vaste stoffen vormen geen enkel gezondheidsrisico. Wie heeft zich ooit druk gemaakt om een zak houtskool? Ze worden massaal verkocht in de gangpaden van sommige markten, en zolang er geen vuur in de buurt is, zullen hun zwarte blokken niet branden..
Coke daarentegen kan een risico vormen als het zwavelgehalte hoog is. Bij verbranding komen zwavelgassen vrij die niet alleen giftig zijn, maar ook bijdragen aan zure regen. En hoewel de COtwee in kleine hoeveelheden kan het ons niet verstikken, het heeft wel een enorme impact op het milieu als broeikasgas.
Vanuit dit perspectief is koolstof een gevaar op de "lange termijn", aangezien de verbranding ervan het klimaat op onze planeet verandert..
En in meer fysieke zin worden de vaste stoffen of koolstofhoudende materialen als ze worden verpulverd, gemakkelijk getransporteerd door luchtstromen; en bijgevolg worden ze rechtstreeks in de longen gebracht, wat ze onherstelbaar kan beschadigen.
Voor de rest is het heel gewoon om "houtskool" te consumeren als er iets gekookt wordt.
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Andrew. (2019). Koolstof, zijn allotropen en structuren. Hersteld van: everyscience.com
- Advameg, Inc. (2019). Steenkool. Chemie uitgelegd. Hersteld van: chemistryexplained.com
- Helmenstine, Anne Marie, Ph.D. (11 juli 2018). 10 koolstoffeiten (atoomnummer 6 of C). Hersteld van: thoughtco.com
- Tawnya Eash. (2019). Wat is koolstof? - Feiten en geschiedenisles voor kinderen. Studie. Hersteld van: study.com
- Föll. (s.f.). Geschiedenis van Carbon. Hersteld van: tf.uni-kiel.de


Niemand heeft nog op dit artikel gereageerd.