
Calciumcarbonaatstructuur, eigenschappen, vorming, gebruik
De calciumcarbonaat is een anorganische verbinding waarvan de chemische formule CaCO is3. Het wordt voornamelijk aangetroffen in mineralen zoals calciet en aragoniet. Het vormt ook kalksteen, een sedimentair gesteente waarin het mineraal calciet aanwezig is..
Dit belangrijke metallische carbonaat wordt industrieel verkregen door extractie en vermaling van de mineralen die het bevatten; Hiervoor wordt voornamelijk marmer gebruikt. Een ander proces is het gebruik van calciumoxide, dat wordt omgezet in calciumhydroxide, waarbij calciumcarbonaat wordt neergeslagen door kooldioxide toe te voegen. Op deze manier worden kristallen met een groot aantal verschillende groottes verkregen..

Ze kunnen ook worden gebruikt voor de industriële productie van CaCO3, op kleine schaal mosselschelpen, eierschalen en oesterschelpen waarin het aanwezig is.
Het calciumcarbonaat dat in kalksteen aanwezig is, wordt opgelost door kooldioxide in het water, waardoor calciumbicarbonaat ontstaat. Deze actie kan holtes veroorzaken en is een oorzaak van alkalisatie van het water; gebeurtenis van groot belang bij het in stand houden van het leven erin.
Het is gebruikt bij de constructie en uitwerking van sculpturen; voorbeelden hiervan zijn het Parthenon in Athene, de kathedraal van Krakau en het beeldhouwwerk van Abraham Lincoln in Washington. Door de gevoeligheid voor zure regen is het gebruik ervan in de bouw echter afgenomen..
Calciumcarbonaat heeft in de industrie meerdere toepassingen gehad als vulmateriaal voor plastic en papier. In de geneeskunde is het gebruikt om de zuurgraad van de maag onder controle te houden; als calciumsupplement in de voeding; om fosfatemie te beheersen bij patiënten met chronisch nierfalen, enz..
Artikel index
- 1 Structuur
- 1.1 Eiwithardheid
- 2 Eigenschappen
- 2.1 Andere namen
- 2.2 Molaire massa
- 2.3 Fysieke beschrijving
- 2.4 Smaak
- 2.5 Smelt- en kookpunten
- 2.6 Oplosbaarheid
- 2.7 Dichtheid
- 2.8 Ontleding
- 2,9 pH
- 2.10 Brekingsindex
- 2.11 Onverenigbaarheden
- 2.12 Enthalpie van fusie
- 2.13 Oplosbaarheid productconstante
- 2.14 Hardheid
- 2.15 Fase-overgangen
- 2.16 Reactiviteit
- 3 Opleiding
- 4 Vormen van calciumcarbonaat
- 5 toepassingen
- 5.1 Industrieel
- 5.2 Artsen
- 5.3 Andere
- 6 referenties
Structuur
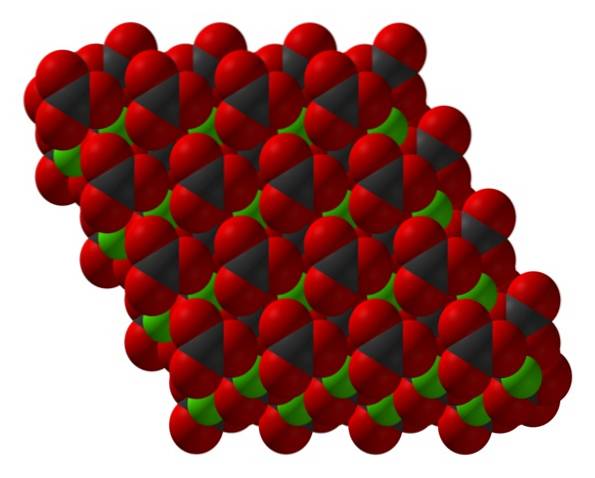
De formule van calciumcarbonaat, CaCO3, geeft aan dat de verhouding van Ca -ionentwee+ en co3twee- is 1: 1; dat wil zeggen, voor elke Catwee+ er is een CO3twee- tegenhanger die er elektrostatisch mee in wisselwerking staat. Dus de ionische binding rangschikt deze ionen om structurele patronen te vormen die een kristal definiëren..
De bovenste afbeelding toont de structuur van CaCO3. De groene bollen komen overeen met kationen Catwee+, en de rode en zwarte bollen naar de CO-anionen3twee-. Merk op dat de structuur uit meerdere lagen lijkt te bestaan: een van calcium en de andere van carbonaat; wat betekent dat het uitkristalliseert tot een compacte zeshoekige structuur.
Deze hexagonale fase (β-CaCO3) komt overeen met een polymorf. Er zijn nog twee andere: de orthorhombische (λ-CaCO3) en een nog dichtere zeshoekige (μ-CaCO3De onderstaande afbeelding helpt om de gelukkige zeshoek beter te visualiseren:
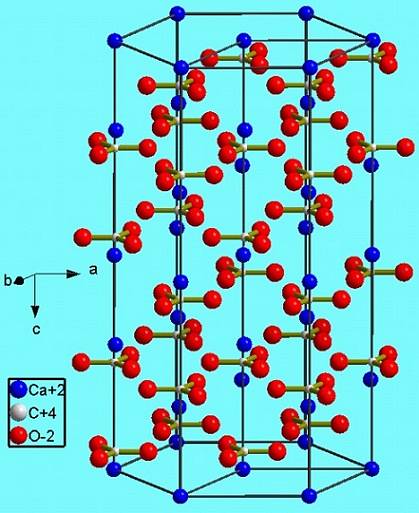
Echter, afhankelijk van de temperatuur (en bij dit zout in mindere mate de druk) passen de ionen zich in hun trillingen weer aan andere structuren aan; dit zijn de reeds genoemde polymorfen (β, λ en μ).
Zoals ze klinken, zijn ze niet erg bekend, tenzij ze in een toekomstige sectie met hun mineralogische namen worden genoemd.
Eiwithardheid
CaCO-kristallen3 Ze zijn niet de enigen: ze kunnen onzuiverheden bevatten, zoals andere metaalkationen die ze kleuren; of eiwitten, die een organische matrix bevatten die op de een of andere manier bijdraagt aan de natuurlijke hardheid ervan.
Eiwitten verminderen de spanning die kristallen tegen elkaar ervaren onder druk of impact. Hoe? Wanneer ze tussen de kristallen worden ingeklemd, zich gedragen alsof het een "kussen" is (vergelijkbaar met de set baksteen-cement-stenen).
Daarom is deze verbinding of mineraal biocompatibel, en het is niet verwonderlijk dat het deel uitmaakt van de nagels, schelpen, schelpen of botten van egels. Het is een inspiratiebron geweest voor degenen die zich toeleggen op het ontwikkelen van nieuwe materialen.
Eigendommen
Andere namen
-Aragoniet
-Calciet
-Volterito
-Calcium melk
-Whiteboard
-Marmeren
Molaire massa
100.086 g / mol.
Fysieke beschrijving
Geurloos wit poeder.
Smaak
Krijtachtig, smaakloos.
Smelt- en kookpunten
Het ontleedt door het vrijkomen van COtwee voordat het zelfs smelt of kookt.
Oplosbaarheid
Vrijwel onoplosbaar in water en alcohol. Het lost bruisend op in verdund azijnzuur en zoutzuur. Hydroxiden verminderen echter de oplosbaarheid ervan. Ondertussen verhogen ammoniumzouten en kooldioxide de oplosbaarheid van calciumcarbonaat in water..
Dichtheid
2,7 tot 2,95 g / cm3.
Ontleding
Bij ongeveer 825 ºC valt het uiteen in calciumoxide (kalk) en kooldioxide (COtwee.
pH
8 tot 9
Brekingsindex
-1,7216 bij 300 nm en 1,6584 bij 589 nm (calciet).
-1.5145 bij 300 nm en 1.4864 bij 589 nm (aragoniet).
Onverenigbaarheden
Met zuren, aluin en ammoniumzouten.
Fusie-enthalpie
36 kJ / mol bij 800 ºC (calciet).
Oplosbaarheid Productconstante
3,36 10-9 bij 25 ºC.
Hardheid
-3.0 (calciet)
-3,5 - 4,0 (aragoniet) op de schaal van Mohs.
Fase-overgangen
Aragoniet is metastabiel en verandert onomkeerbaar in calciet bij verhitting in droge lucht op 400ºC..
Reactiviteit
Calciumcarbonaat reageert met zuren, waarbij kooldioxide, ionisch calcium en water vrijkomen..
Calciumcarbonaat combineert met water verzadigd met kooldioxide, equivalent aan koolzuur (H.tweeCO3), om calciumbicarbonaat te vormen.
Opleiding
Krijt, marmer en kalksteen, de eerste twee mineralen en een rotsachtig materiaal de derde, bevatten calciumcarbonaat en zijn van sedimentaire oorsprong, vermoedelijk gevormd door de sedimentatie van slakken gedurende miljoenen jaren..
PH zou de belangrijkste factor kunnen zijn bij de vorming van polymorfen bij een temperatuur van 24ºC. Vaterite is het belangrijkste product in een pH-bereik tussen 8,5 en 10; aragoniet heeft een pH van 11; en calciet bij pH> 12.
Het is ook bekend dat veel zoetwateralgen calcietkristallen bouwen wanneer ze worden gekweekt in een met calcium verzadigde omgeving. Bovendien kunnen microalgen het neerslaan van calciumcarbonaat veroorzaken.
Vormen van calciumcarbonaat
De onderstaande afbeeldingen tonen de drie belangrijkste vormen of polymorfen voor calciumcarbonaat:



Van boven naar beneden zijn de polymorfen calciet, aragoniet en vateriet. Let op het eerste gezicht op het verschil tussen de morfologie van de kristallen (de kleur is typerend voor de oorsprong en de kenmerken van de omgeving).
Vateriet is ondoorzichtiger dan calciet, de laatste wordt zelfs volledig transparant (IJslandse spar) en is daarom gebruikt in sieraden en optische toepassingen. Ondertussen lijken de aragonietkristallen op kleine langwerpige monolieten.
Als monsters van deze drie polymorfen worden waargenomen onder de elektronenmicroscoop, zouden hun kristallen (met grijsachtige tinten omdat de techniek geen kleurresolutie toestaat) dezelfde morfologieën vinden als op macroscopische schalen; dat wil zeggen in één oogopslag.
Van deze drie polymorfen is calciet de meest voorkomende en stabiele vorm, gevolgd door aragoniet en tenslotte vateriet, de zeldzaamste vorm van CaCO3
Toepassingen
Industrieel
Calciumcarbonaat verhoogt de weerstand tegen torsie en tractie van synthetisch en natuurlijk rubber en behoudt zijn flexibiliteit. Het wordt in de bouw gebruikt als ingrediënt in cement en als grondstof voor kalk. Het gebruik ervan is verminderd omdat het is beschadigd door zure regen.
Calciumcarbonaat wordt gebruikt bij de zuivering van ijzer. In de vorm van kalk verwijdert het het zwaveldioxide dat in het metaal aanwezig is. Het wordt gebruikt bij de zuivering van bietsuiker. Het werd ooit gebruikt als schoolbordkrijt, maar is voor deze toepassing vervangen door gips.
Het calciumcarbonaat wordt gemengd met de stopverf die wordt gebruikt bij de installatie van glas. Grond wordt gebruikt als vulmateriaal in de microporeuze film die in luiers wordt gebruikt. Het wordt ook gebruikt als vulmateriaal in kunststoffen zoals PVC. Bovendien verhoogt het de sterkte van het plastic.
Calciumcarbonaat wordt gebruikt om het dekkingsvermogen van verven te vergroten. Het wordt gebruikt als vulmateriaal voor papier omdat het goedkoper is dan houtvezel en meer dan 10% van het papier kan uitmaken.
Artsen
Het wordt gebruikt als een antacidum om maaghyperaciditeit te bestrijden en indigestie te verlichten. Het wordt gebruikt als calciumsupplement in de voeding en bij de behandeling en preventie van osteoporose. Het wordt gebruikt bij de behandeling van hyperfosfatemie bij patiënten met chronisch nierfalen..
Het is gebruikt om de bijwerkingen van proteaseremmers die worden gebruikt bij de behandeling van HIV te verminderen, waarbij bij patiënten een vermindering van diarree werd waargenomen..
Veroorzaakt een verlaging van de bloeddruk bij zwangere vrouwen met hypertensie en pre-eclampsie, aangezien beide in verband kunnen worden gebracht met een verhoogde vraag naar calcium vanwege de aanwezigheid van de foetus.
Anderen
Calciumcarbonaat wordt in de landbouw gebruikt als meststof en om de zuurgraad van de bodem tegen te gaan. Het wordt gebruikt als conserveermiddel, kleurvasthouder en verstevigend voedsel.
Bovendien is het een ingrediënt in tandpasta en dient het als schuurmiddel in poedervorm bij het schoonmaken en wassen..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Calciumcarbonaat. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). Calciumcarbonaat. PubChem-database., CID = 10112. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Kai-Yin Chong, Chin-Hua Chia en Sarani Zakaria. (2014). Polymorfen Calciumcarbonaat bij temperatuurreactie. AIP Conference Proceedings 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1 november 2016). Ontdekken hoe calciumcarbonaatkristallen kracht krijgen. Voordeel zakelijke marketing. Hersteld van: rdmag.com
- Amerikaanse elementen. (2019). Calciumcarbonaat. Hersteld van: americanelements.com
- ElSevier. (2019). Calciumcarbonaat. ScienceDirect. Hersteld van: sciencedirect.com
- Chemisch boek. (2017). Calciumcarbonaat. Hersteld van: chemicalbook.com



Niemand heeft nog op dit artikel gereageerd.