
Elektrochemische celcomponenten, hoe ze werken, typen, bijvoorbeeld
De elektrochemische cellen Het zijn apparaten waarin chemische reacties plaatsvinden waarbij chemische energie wordt omgezet in elektrische energie of omgekeerd. Deze cellen vormen het hart van de elektrochemie, waarbij de ziel de potentiële uitwisseling van elektronen is die, spontaan of niet, kan plaatsvinden tussen twee chemische soorten..
Een van de twee soorten oxideert, verliest elektronen, terwijl de andere wordt gereduceerd, waardoor de overgedragen elektronen worden gewonnen. Gewoonlijk is de soort die wordt gereduceerd een metallisch kation in oplossing, dat door het winnen van elektronen uiteindelijk elektrisch wordt afgezet op een elektrode die van hetzelfde metaal is gemaakt. Aan de andere kant is de soort die oxideert een metaal dat verandert in metaalkationen.
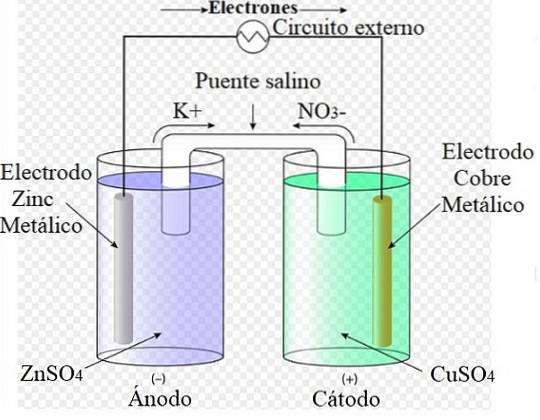
De afbeelding hierboven stelt bijvoorbeeld Daniëls cel voor: de eenvoudigste van alle elektrochemische cellen. De metalen zinkelektrode oxideert, waardoor Zn-kationen vrijkomentwee+ naar het waterige medium. Dit gebeurt in de ZnSO-container4 aan je linker kant.
Aan de rechterkant de oplossing met CuSO4 wordt gereduceerd, waardoor de kationen Cu worden getransformeerdtwee+ in metallisch koper dat is afgezet op de koperelektrode. Tijdens de ontwikkeling van deze reactie reizen de elektronen door een extern circuit dat hun mechanismen activeert; en daarom elektrische energie leveren voor de werking van een team.
Artikel index
- 1 Componenten van elektrochemische cellen
- 1.1 Elektroden
- 1.2 Oplossen van elektrolyten
- 1.3 Zoutbrug
- 2 soorten elektrochemische cellen en hoe ze werken
- 2.1 Galvanisch
- 2.2 Elektrolytica
- 3 voorbeelden
- 3.1 Daniels cel
- 3.2 Platina- en waterstofcel
- 3.3 Verlaagt cel
- 4 referenties
Elektrochemische celcomponenten
Elektroden
Elektrische stromen worden gegenereerd of verbruikt in elektrochemische cellen. Om een voldoende stroom van elektronen te garanderen, moeten er materialen zijn die elektriciteit goed geleiden. Hier komen de elektroden en het externe circuit binnen, voorzien van koperen, zilveren of gouden bedrading..
De elektroden zijn de materialen die het oppervlak vormen waar de reacties zullen plaatsvinden in de elektrochemische cellen. Er zijn twee soorten volgens de reactie die erin optreedt:
-Anode, elektrode waar oxidatie optreedt
-Kathode, elektrode waar reductie optreedt
De elektroden kunnen gemaakt zijn van een reagerend materiaal, zoals in het geval van Daniëls cel (zink en koper); of een inert materiaal, zoals wanneer ze gemaakt zijn van platina of grafiet.
De elektronen die door de anode worden vrijgegeven, moeten de kathode bereiken; maar niet via een oplossing, maar via een metalen kabel die beide elektroden met een extern circuit verbindt.
Oplossen van elektrolyt
De oplossing die de elektroden omgeeft speelt ook een belangrijke rol, aangezien deze is verrijkt met sterke elektrolyten; zoals: KCl, KNO3, NaCl, enz. Deze ionen bevorderen tot op zekere hoogte de migratie van elektronen van de anode naar de kathode, evenals hun geleiding door de nabijheid van de elektroden om in wisselwerking te treden met de soort die moet worden verminderd..
Zeewater geleidt elektriciteit bijvoorbeeld veel beter dan gedestilleerd water, met een lagere ionenconcentratie. Dat is de reden waarom elektrochemische cellen een oplossing hebben van sterke elektrolyten onder hun componenten..
Zoutbrug
De ionen van de oplossing beginnen de elektroden te omringen en veroorzaken een polarisatie van de ladingen. De oplossing rond de kathode begint negatief geladen te worden naarmate de kationen worden gereduceerd; in het geval van Daniëls cel, de Cu-kationentwee+ door afzetting als metallisch koper op de kathode. Er begint dus een tekort aan positieve ladingen te ontstaan.
Dit is waar de zoutbrug tussenkomt om de ladingen in evenwicht te brengen en te voorkomen dat de elektroden polariseren. Naar de zijkant of het compartiment van de kathode zullen kationen migreren van de zoutbrug, ofwel K+ of Zntwee+, om de Cu te vervangentwee+ verbruikt. Ondertussen zullen er GEEN anionen uit de zoutbrug migreren3- richting het anodecompartiment, om de toenemende concentratie van Zn-kationen te neutraliserentwee+.
De zoutbrug is samengesteld uit een verzadigde oplossing van zouten, waarvan de uiteinden bedekt zijn met een gel die ionendoorlatend is, maar ondoordringbaar voor water..
Elektrochemische celtypen en hoe ze werken
Hoe een elektrochemische cel werkt, hangt af van het type. Er zijn in principe twee soorten: galvanisch (of voltaïsch) en elektrolytisch.
Galvanisch
Daniëls cel is een voorbeeld van een galvanische elektrochemische cel. Bij hen treden de reacties spontaan op en is het potentieel van de batterij positief; hoe hoger het potentieel, hoe meer elektriciteit de cel zal leveren.
Cellen of batterijen zijn precies galvanische cellen: het chemische potentieel tussen de twee elektroden wordt omgezet in elektrische energie wanneer een extern circuit tussenkomt dat ze verbindt. De elektronen migreren dus van de anode, ontbranden de apparatuur waarop de batterij is aangesloten en worden direct teruggevoerd naar de kathode.
Elektrolytisch
Elektrolytische cellen zijn cellen waarvan de reacties niet spontaan plaatsvinden, tenzij ze door een externe bron van elektrische energie worden voorzien. Hier doet zich het tegenovergestelde fenomeen voor: elektriciteit zorgt ervoor dat niet-spontane chemische reacties ontstaan.
Een van de bekendste en meest waardevolle reacties die binnen dit type cel plaatsvinden, is elektrolyse..
Oplaadbare batterijen zijn voorbeelden van elektrolytische en tegelijkertijd galvanische cellen: ze worden opgeladen om hun chemische reacties om te keren en de oorspronkelijke omstandigheden voor hergebruik te herstellen..
Voorbeelden
Daniel's cel
De volgende chemische vergelijking komt overeen met de reactie in Daniëls cel waar zink en koper aan deelnemen:
Zn (s) + Cutwee+(aq) → Zntwee+(aq) + Cu (s)
Maar de Cu kationentwee+ en Zntwee+ ze zijn niet alleen, maar vergezeld van de anionen SO4twee-. Deze cel kan als volgt worden weergegeven:
Zn | ZnSO4 CURSUS4 Cu
Daniëls cel kan in elk laboratorium worden gebouwd en is zeer terugkerend als praktijk bij de introductie van elektrochemie. Zoals de Cutwee+ wordt afgezet als Cu, de blauwe kleur van de CuSO-oplossing4 zal verloren gaan.
Platina waterstofcel
Stel je een cel voor die waterstofgas verbruikt, metallisch zilver produceert en tegelijkertijd elektriciteit levert. Dit is de platina- en waterstofcel en de algemene reactie is als volgt:
2AgCl (s) + Htwee(g) → 2Ag (s) + 2H+ + 2Cl-
Hier in het anodecompartiment hebben we een inerte platina-elektrode, ondergedompeld in water en waarin waterstofgas wordt gepompt. De Htwee oxideert tot H+ en geeft zijn elektronen af aan het melkachtige AgCl-neerslag in het kathodecompartiment met een metalen zilveren elektrode. Op dit zilver wordt de AgCl verminderd en zal de massa van de elektrode toenemen..
Deze cel kan worden weergegeven als:
Pt, Htwee H.+ Cl-, AgCl | Ag
Verslaat cel
En tot slot hebben we onder de elektrolytische cellen de gesmolten natriumchloride-cel, beter bekend als de Downs-cel. Hier wordt elektriciteit gebruikt, zodat een volume gesmolten NaCl door de elektroden gaat en de volgende reacties daarin veroorzaakt:
2Na+(l) + 2e- → 2Na (s) (kathode)
2Cl-(l) → Cltwee(g) + 2e- (anode)
2NaCl (l) → 2Na (s) + Cltwee(g) (globale reactie)
Zo kunnen dankzij elektriciteit en natriumchloride metallisch natrium- en chloorgas worden bereid..
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2020). Elektrochemische cel. Hersteld van: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (29 januari 2020). Elektrochemische cellen. Hersteld van: thoughtco.com
- R. Schip. (s.f.). Elektrochemische cellen. Hersteld van: hyperphysics.phy-astr.gsu.edu
- Chemicool. (2017). Definitie van elektrochemische cel. Hersteld van: chemicool.com
- Patricia Jankowski. (2020). Wat is een elektrochemische cel? - Structuur en gebruik. Studie. Hersteld van: study.com
- Alchimie (3 maart 2011). Elektrochemische cellen. Scheikunde en wetenschap. Hersteld van: laquimicaylaciencia.blogspot.com



Niemand heeft nog op dit artikel gereageerd.