
Cyclobutaan structuur, eigenschappen, toepassingen en synthese

De cyclobutaan is een koolwaterstof die bestaat uit een cycloalkaan met vier koolstofatomen, waarvan de molecuulformule C is4H.8. Het kan ook tetramethyleen worden genoemd, aangezien het vier CH-eenheden zijntwee die een ring vormen met vierkante geometrie, hoewel de naam cyclobutaan meer geaccepteerd en bekend is.
Bij kamertemperatuur is het een kleurloos, brandbaar gas dat brandt met een heldere vlam. Het meest primitieve gebruik ervan is als warmtebron bij het verbranden ervan; De structurele basis (het vierkant) omvat echter diepe biologische en chemische aspecten en werkt op een bepaalde manier samen met de eigenschappen van deze verbindingen..
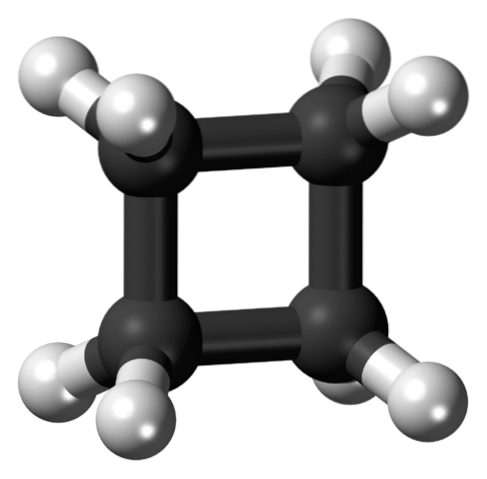
De bovenste afbeelding toont een cyclobutaanmolecuul met een vierkante structuur. In de volgende sectie zullen we uitleggen waarom deze conformatie onstabiel is, aangezien de schakels gespannen zijn..
Na cyclopropaan is het het meest onstabiele cycloalkaan, want hoe kleiner de ringmaat, hoe reactiever het zal zijn. Volgens dit is het cyclobutaan instabieler dan de pentaan- en hexaancycli. Het is echter merkwaardig om in zijn afgeleiden getuige te zijn van een kern of vierkant hart, dat, zoals we zullen zien, dynamisch is.
Artikel index
- 1 Structuur van cyclobutaan
- 1.1 Vlinder- of gerimpelde conformaties
- 1.2 Intermoleculaire interacties
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molecuulmassa
- 2.3 Kookpunt
- 2.4 Smeltpunt
- 2.5 Vlampunt
- 2.6 Oplosbaarheid
- 2.7 Dichtheid
- 2.8 Dampdichtheid
- 2.9 Dampspanning
- 2.10 Brekingsindex
- 2.11 Enthalpie van verbranding
- 2.12 Vormingswarmte
- 3 Synthese
- 4 toepassingen
- 5 referenties
Structuur van cyclobutaan
In de eerste afbeelding werd de structuur van cyclobutaan benaderd als een eenvoudig verkoold en gehydrogeneerd vierkant. In dit perfecte vierkant ondergaan de orbitalen echter een ernstige draai ten opzichte van hun oorspronkelijke hoeken: ze zijn gescheiden door een hoek van 90º vergeleken met 109,5º voor een koolstofatoom met sp-hybridisatie.3 (hoekspanning).
Koolstofatomen sp3 ze zijn tetraëdrisch, en voor sommige tetraëders zou het moeilijk zijn om hun orbitalen zo ver te buigen om een hoek van 90 ° te creëren; maar het zou zelfs nog meer het geval zijn voor koolstofatomen met sp-hybridisatiestwee (120º) en sp (180º) wijken af van hun oorspronkelijke hoeken. Om deze reden heeft cyclobutaan sp koolstofatomen3 in essentie.
Ook staan waterstofatomen heel dicht bij elkaar, verduisterd in de ruimte. Dit resulteert in een toename van sterische hinder, die het veronderstelde vierkant verzwakt vanwege de hoge torsiespanning..
Daarom maken hoek- en torsiespanningen (ingekapseld in de term 'ringspanning') deze conformatie onder normale omstandigheden onstabiel..
Het cyclobutaanmolecuul zal proberen beide spanningen te verminderen en om dit te bereiken neemt het de zogenaamde vlinder- of gebobbelde conformatie aan..
Vlinder- of gerimpelde conformaties
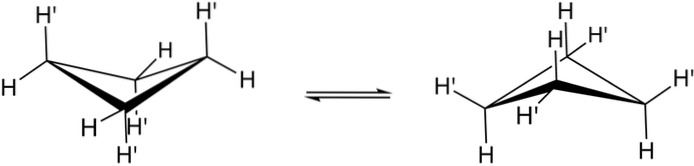
De echte conformaties van cyclobutaan worden hierboven getoond. Bij hen nemen de hoek- en torsiespanningen af; aangezien, zoals te zien is, nu niet alle waterstofatomen worden overschaduwd. Er zijn echter energiekosten: de hoek van de schakels wordt verscherpt, dat wil zeggen, hij daalt van 90 naar 88 °.
Merk op dat het kan worden vergeleken met een vlinder, waarvan de driehoekige vleugels zijn opgebouwd uit drie koolstofatomen; en de vierde, gepositioneerd onder een hoek van 25º ten opzichte van elke vleugel. De tweerichtingspijlen geven aan dat er een evenwicht is tussen beide conformeren. Het is alsof de vlinder naar beneden ging en zijn vleugels opsloeg.
Bij cyclobutaanderivaten zou dit klappen daarentegen veel langzamer en ruimtelijk belemmerd moeten zijn..
Intermoleculaire interacties
Stel dat je de vierkanten even vergeet, en in plaats daarvan worden ze vervangen door koolzuurhoudende vlinders. Deze in hun klapperende bewegingen kunnen alleen in de vloeistof bij elkaar worden gehouden door Londense dispersiekrachten, die evenredig zijn met het oppervlak van hun vleugels en hun moleculaire massa..
Eigendommen
Fysiek uiterlijk
Kleurloos gas.
Moleculaire massa
56,107 g / mol.
Kookpunt
12,6 ° C. Daarom zou het in koude omstandigheden in principe als elke vloeistof kunnen worden gehanteerd; met als enige detail dat het zeer vluchtig zou zijn en dat de dampen nog steeds een risico zouden vormen waarmee rekening moet worden gehouden.
Smeltpunt
-91ºC.
ontstekingspunt
50ºC gesloten glas.
Oplosbaarheid
Onoplosbaar in water, wat niet verwonderlijk is gezien de niet-polaire aard ervan; maar het is enigszins oplosbaar in alcoholen, ether en aceton, die minder polaire oplosmiddelen zijn. Het is naar verwachting oplosbaar (hoewel niet vermeld) logisch in apolaire oplosmiddelen zoals tetrachloorkoolstof, benzeen, xyleen, enz..
Dichtheid
0,7125 bij 5ºC (in verhouding tot 1 van het water).
Dampdichtheid
1,93 (in verhouding tot 1 van de lucht). Dit betekent dat het dichter is dan lucht, en daarom zal het, tenzij er stroming is, niet stijgen..
Dampdruk
1.180 mmHg bij 25ºC.
Brekingsindex
1.3625 bij 290ºC.
Enthalpie van verbranding
-655,9 kJ / mol.
Warmte van vorming
6,6 Kcal / mol bij 25ºC.
Synthese
Cyclobutaan wordt gesynthetiseerd door hydrogenering van cyclobutadieen, waarvan de structuur bijna hetzelfde is, met het enige verschil dat het een dubbele binding heeft; en daarom is het zelfs nog reactiever. Dit is misschien de eenvoudigste synthetische route om het te verkrijgen, of in ieder geval alleen naar het en niet naar een derivaat.
In ruwe olie is het onwaarschijnlijk dat het wordt verkregen, omdat het uiteindelijk zo reageert dat het de ring breekt en de lijnketting vormt, dat wil zeggen n-butaan.
Een andere methode om cyclobutaan te verkrijgen bestaat uit opvallende ultraviolette straling op de ethyleenmoleculen, CHtwee= CHtwee, die dimeriseren. Deze reactie wordt fotochemisch begunstigd, maar niet thermodynamisch:
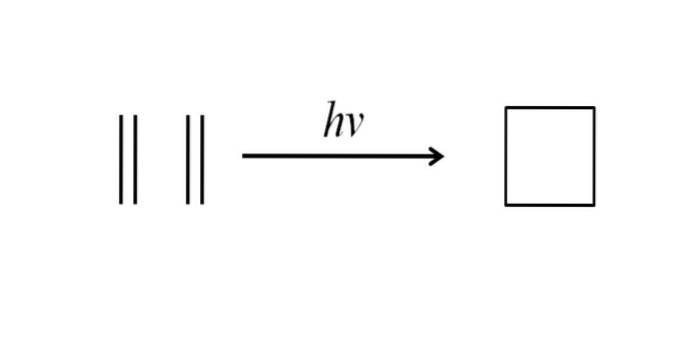
De afbeelding hierboven vat heel goed samen wat er in de bovenstaande paragraaf werd gezegd. Als men in plaats van ethyleen bijvoorbeeld twee alkenen had, zou een gesubstitueerd cyclobutaan worden verkregen; of wat hetzelfde is, een derivaat van cyclobutaan. In feite zijn er met deze methode veel derivaten met interessante structuren gesynthetiseerd..
Andere derivaten omvatten echter een reeks gecompliceerde synthetische stappen. Daarom zijn cyclobutanen (zoals hun derivaten worden genoemd) het onderwerp van studie voor organische syntheses..
Toepassingen
Cyclobutaan alleen heeft geen ander nut dan als warmtebron te dienen; maar, zijn derivaten, betreden ingewikkeld terrein in organische synthese, met toepassingen in farmacologie, biotechnologie en geneeskunde. Zonder in al te complexe structuren te duiken, zijn penitrems en grandisol voorbeelden van cyclobutanen.
Cyclobutanen hebben over het algemeen eigenschappen die gunstig zijn voor het metabolisme van bacteriën, planten, ongewervelde zeedieren en schimmels. Ze zijn biologisch actief en daarom zijn hun toepassingen zeer gevarieerd en moeilijk te specificeren, aangezien elk hun specifieke effect op bepaalde organismen heeft..
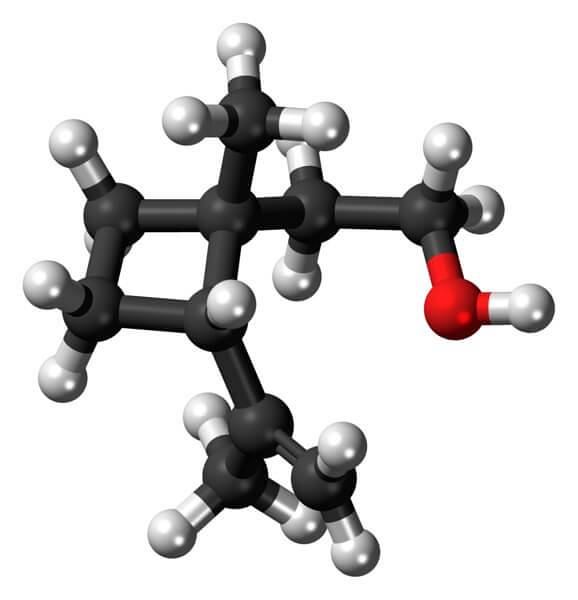
Grandisol is bijvoorbeeld een feromoon van de snuitkever (een soort kever). Hierboven, en ten slotte, wordt de structuur getoond, beschouwd als een monoterpeen met een vierkante basis van cyclobutaan.
Referenties
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons, T.W.; Craig B. Fryhle. (2011). Organische chemie. (elfth editie). Wiley.
- Wikipedia. (2019). Cyclobutaan. Hersteld van: en.wikipedia.org
- PubChem. (2019). Cyclobutaan. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (2015, 29 november). Fysieke eigenschappen van cycloalkanen. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Cyclobutaan-fysische eigenschappen en theoretische studies. Afdeling Chemie, Yale University.
- Klement Foo. (s.f.). Cyclobutanen in organische synthese. Hersteld van: scripps.edu
- Myers. (s.f.). Cyclobutanen synthese. Chem 115. Opgehaald van: hwpi.harvard.edu


Niemand heeft nog op dit artikel gereageerd.