
Moleculaire structuur waterstofcyanide, eigenschappen, toepassingen
De blauwzuur of waterstofcyanide is een organische verbinding waarvan de chemische formule HCN is. Het is ook bekend als methanonitril of formonitril en, tot enkele jaren geleden, als blauwzuur, hoewel dit eigenlijk een andere verbinding is.
Blauwzuur is een uiterst giftig, kleurloos gas dat wordt verkregen door cyaniden met zuren te behandelen. Dit zuur wordt aangetroffen in het zaad van perziken, ook wel op veel plaatsen bekend als perziken..

Bij een omgevingstemperatuur van minder dan 25 ºC is het een vloeistof en daarboven is het een gas. In beide gevallen is het buitengewoon giftig voor mensen, dieren en zelfs voor de meeste micro-organismen die er niet aan gewend zijn. Het is een goed oplosmiddel voor ionen. Het is erg onstabiel omdat het gemakkelijk de neiging heeft om te polymeriseren.
Het wordt in het plantenrijk opgenomen in de moleculen van sommige glycosiden, omdat wanneer deze worden gehydrolyseerd door enzymen van de plant, HCN, glucose en benzaldehyde worden verkregen..
Deze glycosiden zitten in de zaden van bepaalde soorten fruit zoals perziken, abrikozen, kersen, pruimen en in bittere amandelen, dus ze mogen nooit worden ingenomen..
Het wordt ook aangetroffen in plantenglycosiden, zoals sommige soorten sorghum. Sommige bacteriën produceren het ook tijdens hun metabolisme. Het wordt voornamelijk gebruikt bij de productie van polymeren en in sommige metallurgische processen.
HCN is een dodelijk gif bij inademing, inslikken en contact. Het is aanwezig in sigarettenrook en in de rook van branden van kunststoffen en materialen die koolstof en stikstof bevatten. Het wordt beschouwd als een luchtverontreinigende stof omdat het wordt geproduceerd tijdens de verbranding van organisch materiaal uit grote delen van de planeet.
Artikel index
- 1 Moleculaire structuur en elektronische configuratie
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Vlampunt
- 3.6 Zelfontbrandingstemperatuur
- 3.7 Dichtheid
- 3.8 Oplosbaarheid
- 3.9 Dissociatieconstante
- 3.10 Enkele chemische eigenschappen
- 3.11 Corrosiviteit
- 4 Locatie in de natuur
- 5 toepassingen
- 5.1 Bij de bereiding van andere chemische verbindingen en polymeren
- 5.2 Diverse toepassingen
- 5.3 In de landbouw
- 6 Risico's
- 6.1 Mechanisme van dodelijke actie in het lichaam
- 6.2 Risico op sigarettenrook
- 6.3 Risico's van verhitting HCN
- 6.4 Aanwezigheid van HCN in rook door brand
- 6.5 Luchtverontreinigende stof
- 7 referenties
Moleculaire structuur en elektronische configuratie
Blauwzuur of waterstofcyanide is een covalente, moleculaire verbinding met één waterstofatoom, één koolstofatoom en één stikstofatoom..
Het koolstofatoom en het stikstofatoom delen 3 elektronenparen, dus ze vormen een drievoudige binding. Waterstof is gebonden aan koolstof, dat met deze binding zijn valentie van vier en zijn volledige elektronenoctet vertoont.
Stikstof heeft een valentie van vijf en om zijn octet te voltooien heeft het een paar ongepaarde of solitaire elektronen die lateraal zijn gelokaliseerd.
HCN is daarom een volledig lineair molecuul, met een ongepaard elektronenpaar lateraal in de stikstof..
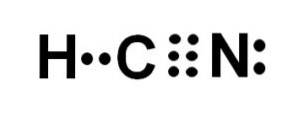
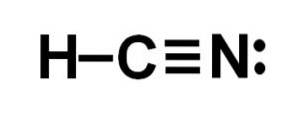
Nomenclatuur
- Blauwzuur
- Waterstofcyanide
- Methanonitril
- Formonitril
- Blauwzuur
Eigendommen
Fysieke toestand
Beneden 25,6 ºC, als het watervrij en gestabiliseerd is, is het een kleurloze of lichtblauwe vloeistof die zeer onstabiel en giftig is. Als het boven die temperatuur is, is het een uiterst giftig kleurloos gas.
Molecuulgewicht
27,03 g / mol
Smeltpunt
-13,28 ºC
Kookpunt
25,63 ºC (merk op dat het net boven kamertemperatuur kookt).
Vlampunt
-18 ºC (methode met gesloten kroes)
Zelfontbranding temperatuur
538 ºC
Dichtheid
0,6875 g / cm3 bij 20 ºC
Oplosbaarheid
Volledig mengbaar met water, ethylalcohol en ethylether.
Dissociatieconstante
K = 2,1 x 10-9
pKnaar = 9.2 (het is een erg zwak zuur)
Enkele chemische eigenschappen
HCN heeft een zeer hoge diëlektrische constante (107 tot 25 ºC). Dit komt omdat de moleculen erg polair zijn en zich associëren via waterstofbruggen, zoals in het geval van water HtweeOF.
Vanwege de hoge diëlektrische constante blijkt HCN een goed ioniserend oplosmiddel te zijn..
Vloeibaar watervrij HCN is erg onstabiel, het heeft de neiging heftig te polymeriseren. Om dit te voorkomen worden stabilisatoren toegevoegd, zoals een klein percentage H.tweeSW4.
In waterige oplossing en in aanwezigheid van ammoniak en hoge druk vormt het adenine, een verbinding die deel uitmaakt van DNA en RNA, dat wil zeggen een biologisch belangrijk molecuul.
Het is een zeer zwak zuur, aangezien de ionisatieconstante erg klein is, dus het ioniseert slechts gedeeltelijk in water, waardoor het cyanide-anion CN-. Vormt zouten met basen maar niet met carbonaten.
De waterige oplossingen die niet tegen licht worden beschermd, ontleden langzaam en vormen daarbij ammoniumformiaat HCOONH4.
In oplossing heeft het een zwakke amandelgeur.
Corrosiviteit
Omdat het een zwak zuur is, is het over het algemeen niet corrosief.
Waterige oplossingen van HCN die zwavelzuur als stabilisator bevatten, tasten staal echter sterk aan bij temperaturen boven 40 ºC en roestvrij staal bij temperaturen boven 80 ºC..
Bovendien kunnen verdunde waterige oplossingen van HCN zelfs bij kamertemperatuur spanning op koolstofstaal veroorzaken..
Het kan ook bepaalde soorten rubbersoorten, kunststoffen en coatings aantasten.
Locatie in de natuur
Het wordt relatief overvloedig aangetroffen in het plantenrijk als onderdeel van glycosiden.
Het wordt bijvoorbeeld gegenereerd uit amygdaline C6H.5-CH (-CN) -O-Glucose-O-Glucose, een stof die aanwezig is in bittere amandelen. Amygdalin is een cyanogeen bèta-glucoside, aangezien het bij hydrolyse twee glucosemoleculen vormt, een van benzaldehyde en een van HCN. Het enzym dat ze afgeeft, is bèta-glucoxidase.
Amygdalin is te vinden in de zaden van perziken, abrikozen, bittere amandelen, kersen en pruimen..
Sommige soorten sorghumplanten bevatten de cyanogene glycoside durrin (d.w.z. p-hydroxy- (S) -mandelonitril-beta-D-glucoside). Deze verbinding kan worden afgebroken door een tweestaps enzymatische hydrolyse.
Ten eerste hydrolyseert het enzym durrinase dat endogeen is in sorghumplanten het tot glucose en p-hydroxy- (S) -mandelonitril. Dit laatste wordt vervolgens snel omgezet in vrij HCN en p-hydroxybenzaldehyde.

HCN is verantwoordelijk voor de weerstand van sorghumplanten tegen ongedierte en ziekteverwekkers.
Dit wordt verklaard door het feit dat durrin en het enzym durrinase verschillende locaties in deze planten hebben, en ze komen alleen in contact als de weefsels gewond of vernietigd zijn, waardoor het HCN vrijkomt en de plant wordt beschermd tegen infecties die door het gewonde deel zouden kunnen dringen..
Bovendien kunnen sommige menselijke pathogene bacteriën zoals Pseudomonas aeruginosa Y P. gingivalis ze produceren het tijdens hun metabolische activiteit.
Toepassingen
Bij de bereiding van andere chemische verbindingen en polymeren
Het gebruik waarbij het grootste deel van het op industrieel niveau geproduceerde HCN is betrokken, is de bereiding van tussenproducten voor organische synthese..
Het wordt gebruikt bij de synthese van adiponitril NC- (CHtwee4-CN, dat wordt gebruikt om nylon of nylon een polyamide te maken. Het wordt ook gebruikt om acrylonitril of cyaanethyleen CH te bereidentwee= CH-CN, gebruikt om acrylvezels en kunststoffen te maken.
Het derivaat natriumcyanide NaCN wordt gebruikt voor de winning van goud bij de winning van dit metaal.
Een andere van zijn derivaten, het cyanogeenchloride ClCN, wordt gebruikt voor formules voor pesticiden.
HCN wordt gebruikt voor de bereiding van chelaatvormers zoals EDTA (ethyleen-diamine-tetra-acetaat).
Het wordt gebruikt voor de vervaardiging van ferrocyaniden en sommige farmaceutische producten.
Diverse toepassingen
HCN-gas is gebruikt als insecticide, fungicide en ontsmettingsmiddel voor het begassen van schepen en gebouwen. Ook om meubels te ontsmetten om ze te herstellen.
HCN is gebruikt bij het polijsten van metalen, het galvaniseren van metalen, fotografische processen en metallurgische processen..
Vanwege zijn hoge toxiciteit werd het aangewezen als middel voor chemische oorlogsvoering..
In de landbouw
Het is gebruikt als herbicide en pesticide in boomgaarden. Het werd gebruikt om schubben en andere ziekteverwekkers op citrusbomen te bestrijden, maar sommige van deze plagen zijn resistent geworden tegen HCN.
Het is ook gebruikt om graansilo's te ontsmetten. Ter plaatse bereid HCN-gas is gebruikt bij de ontsmetting van tarwekorrels om ze te beschermen tegen ongedierte zoals insecten, schimmels en knaagdieren. Voor dit gebruik is het essentieel dat de te ontsmetten zaden het bestrijdingsmiddel verdragen..
Er zijn tests gedaan door tarwezaden met HCN te besproeien en er is vastgesteld dat het hun kiemkracht niet negatief beïnvloedt, maar eerder lijkt te begunstigen..
Hoge doses HCN kunnen echter de lengte van de kleine bladeren die uit het zaad ontspruiten aanzienlijk verminderen..
Aan de andere kant, vanwege het feit dat het een krachtige nematicide is en dat sommige sorghumplanten het in hun weefsels hebben, wordt het potentieel van sorghumplanten om te worden gebruikt als biocide groenbemester onderzocht..
Het gebruik ervan zou dienen om bodems te verbeteren, onkruid te bestrijden en ziekten en schade veroorzaakt door fytoparasitaire nematoden te bestrijden..
Risico's
Voor mensen is HCN een dodelijk gif via alle wegen: inademing, inslikken en contact..

Inhalatie kan dodelijk zijn. Geschat wordt dat ongeveer 60-70% van de bevolking de bittere amandelgeur van HCN kan detecteren wanneer het zich in de lucht bevindt in een concentratie van 1-5 ppm.
Maar er is 20% van de bevolking die het niet kan detecteren, zelfs niet bij dodelijke concentraties, omdat ze dat genetisch niet kunnen.
Opgenomen, is het een acuut en onmiddellijk werkend gif..
Als hun oplossingen in contact komen met de huid, kan het bijbehorende cyanide dodelijk zijn.
HCN is aanwezig in sigarettenrook en wordt gegenereerd wanneer kunststoffen met stikstof worden verbrand.
Dodelijk werkingsmechanisme in het lichaam
Het is een chemische verstikking en is snel giftig, vaak met de dood tot gevolg. Bij binnenkomst in het lichaam bindt het zich aan metallo-enzymen (enzymen die een metaalion bevatten), waardoor het wordt geïnactiveerd. Het is een giftig middel voor verschillende organen van het menselijk lichaam
Het belangrijkste toxische effect ervan is de remming van cellulaire ademhaling, omdat het een enzym deactiveert dat de fosforylering in mitochondriën beïnvloedt, dit zijn organellen die onder andere ingrijpen in de ademhalingsfunctie van cellen..
Risico op sigarettenrook
HCN is aanwezig in sigarettenrook.
Hoewel veel mensen het vergiftigende effect van HCN kennen, beseffen maar weinig mensen dat ze worden blootgesteld aan het schadelijke effect ervan door sigarettenrook..
HCN is een van de oorzaken van de remming van verschillende cellulaire ademhalingsenzymen. De hoeveelheid HCN die in sigarettenrook aanwezig is, heeft een bijzonder schadelijk effect op het zenuwstelsel..
HCN-niveaus in sigarettenrook zijn gerapporteerd tussen 10 en 400 μg per sigaret voor direct ingeademde rook en 0,006 tot 0,27 μg / sigaret voor secundaire inademing (passief roken). HCN veroorzaakt toxische effecten vanaf 40 μM.

Bij inademing komt het snel in de bloedbaan, waar het wordt afgegeven aan plasma of zich bindt aan hemoglobine. Een klein deel wordt omgezet in thiocyanaat en uitgescheiden in de urine.
Risico's van HCN-verwarming
Langdurige blootstelling aan hitte van vloeibaar HCN in gesloten containers kan onverwacht heftig scheuren van de containers veroorzaken. Kan explosief polymeriseren bij 50-60 ° C in aanwezigheid van sporen van alkali en in afwezigheid van remmers.
Aanwezigheid van HCN in rook van branden
HCN komt vrij bij de verbranding van stikstofhoudende polymeren, zoals onder meer wol, zijde, polyacrylonitrilen en nylon. Deze materialen zijn aanwezig in onze huizen en op de meeste plaatsen van menselijke activiteit.
Om deze reden kan HCN tijdens branden mogelijk de doodsoorzaak zijn bij inademing..
Vervuiler van de atmosfeer
HCN is een verontreinigende stof in de troposfeer. Het is bestand tegen fotolyse en ondergaat onder de omgevingsomstandigheden van de atmosfeer geen hydrolyse.
Fotochemisch geproduceerde hydroxyl OH-radicalen kunnen reageren met HCN, maar de reactie is erg traag, dus de halfwaardetijd van HCN in de atmosfeer is 2 jaar.
Bij het verbranden van biomassa, vooral turf, komt HCN vrij in de atmosfeer, maar ook bij industriële activiteiten. De verbranding van turf is echter 5 tot 10 keer meer vervuilend dan de verbranding van andere soorten biomassa.
Sommige onderzoekers hebben ontdekt dat de hoge temperaturen en droogte veroorzaakt door het El Niño-fenomeen in bepaalde delen van de planeet seizoensbranden verergeren in gebieden met een hoog gehalte aan afgebroken plantaardig materiaal..

Dit leidt tot een intense verbranding van biomassa in droge seizoenen..
Deze gebeurtenissen zijn de bron van hoge concentraties HCN in de troposfeer, die uiteindelijk naar de lagere stratosfeer worden getransporteerd, waar ze zeer lang blijven bestaan..
Referenties
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Waterstofcyanide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Waterstofcyanide-een update. Arbeidsgeneeskunde 2017; 67: 662-663. Opgehaald van ncbi.nlm.nih.gov.
- Van Nostrands Scientific Encyclopedia. (2005). Waterstofcyanide. 9th Hersteld van onlinelibrary.wiley.com.
- Ren, Y.-L. et al. (1996). Effect van waterstofcyanide en carbonylsulfide op de kieming en plumule-kracht van tarwe. Pesticiden. Sci. 1996, 47, 1-5. Hersteld van onlinelibrary.wiley.com.
- Van Nicola, G.R. et al. (2011). Een eenvoudige analytische methode voor de evaluatie van het Dhurrin-gehalte in cyanogene planten voor hun gebruik in veevoeder en biofumigatie. J. Agric. Voedsel Chem.2011, 59, 8065-8069. Opgehaald van pubs.acs.org.
- Sheese, P.E. et al. (2017). Een wereldwijde verbetering van waterstofcyanide in de lagere stratosfeer gedurende 2016. Geophys. Res. Lett., 44, 5791-5797. Hersteld van agupubs.onlinelibrary.wiley.com.
- Surleva, A.R. en Drochioiu, G. (2013). Rookgevaar visualiseren: een eenvoudige spectrofotometrische bepaling van waterstofcyanide in sigarettenrook en filters. J. Chem. Educ. 2013, 90, 1654-1657. Opgehaald van pubs.acs.org.
- Alarie, Y. et al. (1990). De rol van waterstofcyanide bij menselijke sterfgevallen bij brand. In vuur en polymeren. Hoofdstuk 3. ACS Symposium Series. Opgehaald van pubs.acs.org.

Niemand heeft nog op dit artikel gereageerd.