
Hypojoodzuur (HIO) formule, eigenschappen en toepassingen

De hypojoodzuur, ook bekend als waterstofmonoxoiodaat (I) of jood, het is een anorganische verbinding met formule HIO. Het is een oxacid van jodium, met een zuurstofatoom, een waterstofatoom en een jodiumatoom met een oxidatietoestand van 1+.
De verbinding is erg onstabiel omdat het de neiging heeft om een dismutatiereactie te ondergaan waarbij het wordt gereduceerd tot moleculair jodium en geoxideerd tot jodiumzuur volgens de reactie: 5HIO → 2Itwee + HIO3 + 2HtweeOF.
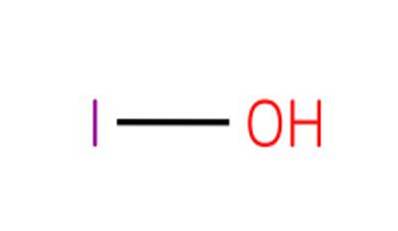
De verbinding is het zwakste zuur van de 1+ oxidatietoestand halogeenoxzuren. De overeenkomstige zouten van dit zuur staan bekend als hypojodieten.
Deze zouten zijn stabieler dan zuur en worden op dezelfde manier gevormd als hun chloor- en broom-tegenhangers, door moleculair jodium te laten reageren met alkali- of aardalkalimetaalhydroxiden..
Hypo-jodiumzuur wordt geproduceerd door moleculair jodium te laten reageren met kwik (II) oxide (Egon Wiberg, 2001) volgens de reactie:
2Itwee + 3HgO + HtweeO → 2HIO + HgItwee ● 2HgO
Sporen van de verbinding worden ook verkregen door moleculair jodium te laten reageren met kaliumhydroxide om aanvankelijk kaliumjodide en kaliumhypojodiet te vormen volgens de reactie:
iktwee + 2KOH → KI + KIO
Hypojoodzuur, dat zo'n zwak zuur is, maakt de hydrolyse van kaliumhypojodiet echter mogelijk, tenzij er een overmaat aan kaliumhydroxide is (Holmyard, 1922).
KIO + HtweeO → HIO + KOH
Het kan ook worden verkregen, net als zijn chloor- en broom-tegenhangers, door moleculair jodium te laten reageren met water. Gezien de lage evenwichtsconstante, die in de orde van grootte van 10 ligt-13, de verkregen hoeveelheden zijn erg klein (R.G. Compton, 1972).
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen
Hypojoodzuur bestaat alleen als een waterige oplossing die gelig van kleur is. De verbinding in vaste toestand is niet geïsoleerd, dus de meeste eigenschappen worden theoretisch verkregen door middel van computationele berekeningen (National Center for Biotechnology Information, 2017).
Hypojoodzuur heeft een molecuulgewicht van 143,911 g / mol, een smeltpunt van 219,81 ° C, een kookpunt van 544,27 ° C en een dampspanning van 6,73 x 10-14 millimeter kwik.
Het molecuul is zeer oplosbaar in water en kan tussen 5,35 x 10 oplossen5 en 8,54 x 105 gram verbinding per liter van dit oplosmiddel (Royal Society of Chemistry, 2015).
HOI is een sterk oxidatiemiddel en kan explosieve mengsels vormen. Het is ook een reductiemiddel en kan worden geoxideerd tot de jodium-, jodium- en periodieke vormen van het zuur. In waterige oplossingen, omdat het een zwak zuur is, dissocieert het gedeeltelijk in het hypojodiet-ion (OI-) en H+.
HOI reageert met basen om zouten te vormen die hypojodieten worden genoemd. Natriumhypojodiet (NaOI) wordt bijvoorbeeld gevormd door hypojoodzuur te laten reageren met natriumhydroxide..
HOI + NaOH → NaOI + HtweeOF
Hypojoodzuur reageert ook gemakkelijk met een verscheidenheid aan organische moleculen en biomoleculen..
Reactiviteit en gevaren
Hypojoodzuur is een onstabiele verbinding die ontleedt tot elementair jodium. Jodium is een giftige stof waarmee met zorg moet worden omgegaan.
Hypojoodzuur is gevaarlijk bij contact met de huid (irriterend), bij contact met de ogen (irriterend) en bij inslikken en inademen.
Controleer in geval van contact met de ogen of u contactlenzen draagt en verwijder deze onmiddellijk. Ogen moeten gedurende minstens 15 minuten met stromend water worden gespoeld, waarbij de oogleden open moeten blijven. Koud water kan worden gebruikt. Oogzalf mag niet worden gebruikt.
Als de chemische stof in contact komt met kleding, moet u deze zo snel mogelijk verwijderen en daarbij uw eigen handen en lichaam beschermen. Plaats het slachtoffer onder een veiligheidsdouche.
Als de chemische stof zich ophoopt op de blootgestelde huid van het slachtoffer, zoals de handen, wordt de besmette huid voorzichtig en voorzichtig gewassen met stromend water en niet-schurende zeep. Koud water kan worden gebruikt. Roep medische hulp in als de irritatie aanhoudt. Was de besmette kleding voordat u deze opnieuw gebruikt.
Als het contact met de huid ernstig is, moet deze worden gewassen met een desinfecterende zeep en de besmette huid bedekken met een antibacteriële crème..
Bij inademing moet het slachtoffer rusten in een goed geventileerde ruimte. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilige plaats worden geëvacueerd. Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas.
Als het slachtoffer moeite heeft met ademen, moet zuurstof worden toegediend. Als het slachtoffer niet ademt, wordt mond-op-mondbeademing uitgevoerd. Houd er altijd rekening mee dat het gevaarlijk kan zijn voor de persoon die hulp verleent om mond-op-mondbeademing te geven wanneer het ingeademde materiaal giftig, besmettelijk of bijtend is..
Bij inslikken geen braken opwekken. Maak strak zittende kleding los, zoals kragen, riemen of stropdassen. Als het slachtoffer niet ademt, voer dan mond-op-mondbeademing uit.
Zoek in alle gevallen onmiddellijk medische hulp..
Toepassingen
Hypojoodzuur wordt gebruikt als een krachtig oxidatiemiddel en als reductiemiddel bij laboratoriumreacties. Het wordt gebruikt om chemische verbindingen te produceren die bekend staan als hypojodieten..
Spectrofotometrische methoden worden ook gebruikt om de vorming van hypojoodzuur te meten om reacties te volgen waarbij jodium betrokken is (T. L. Allen, 1955).
Halogeniden worden opgenomen in spuitbussen, waar ze beginnen met de katalytische vernietiging van ozon (O3) over de oceanen en hebben invloed op de mondiale troposfeer. Twee intrigerende milieuproblemen die momenteel worden onderzocht, zijn: begrijpen hoe moleculaire halogenen in de reactieve gasfase rechtstreeks worden geproduceerd uit anorganische halogeniden die zijn blootgesteld aan O3 en beperk de omgevingsfactoren die dit grensvlakproces beheersen.
In het werk van (Elizabeth A. Pillar, 2013) werd de omzetting van jodide in hypojoodzuur door de werking van ozon gemeten door middel van massaspectroscopiemetingen om een model van ozonafbraak in de atmosfeer te bepalen..
Referenties
- Egon Wiberg, N. W. (2001). Anorganische scheikunde. London: Academische pers.
- Elizabeth A. Pillar, M. I. (2013). Omzetting van jodide in hypojoodzuur en jodium in waterige microdruppels blootgesteld aan ozon. Sci. Technol., 47 (19), 10971-10979.
- EMBL-EBI. (2008, 5 januari). hypojoodzuur. Opgehaald van ChEBI: ebi.ac.uk.
- Holmyard, E. (1922). Anorganische scheikunde. Londen: Edwar Arnol & co.
- Nationaal centrum voor informatie over biotechnologie ... (2017, 22 april). PubChem samengestelde database; CID = 123340. Opgehaald van PubChem.
- G. Compton, C. B. (1972). Reacties van niet-metalen anorganische verbindingen. Ansterdam: Elsevier Publishing Company.
- Royal Society of Chemistry. (2015). Iodol. Opgehaald van chemspider.com.
- L. Allen, R. M. (1955). De vorming van hypojoodzuur en gehydrateerd jodiumkation door de hydrolyse van jodium. J. Am. Chem. Soc., 77 (11) , 2957-2960.



Niemand heeft nog op dit artikel gereageerd.