
Natriumbisulfiet (NaHSO3) structuur, eigenschappen, gebruik, productie

De natriumbisulfiet is een anorganische vaste stof gevormd door een natriumion Na+ en een bisulfietion HSO3-. De chemische formule is NaHSO3. Het is een witte kristallijne vaste stof en wordt vanwege zijn antioxiderende eigenschappen veel gebruikt als conserveermiddel voor voedsel (bijvoorbeeld in sommige jam).
De NaHSO3 het is een reducerende chemische verbinding, die het tegenovergestelde is van oxidatiemiddel, en daarom werkt het als een antioxidant in veel van zijn toepassingen, zoals in eetbare producten, omdat het de achteruitgang ervan voorkomt.

Dit gebruik is echter in twijfel getrokken, omdat gevallen van astma zijn gemeld bij mensen nadat ze voedsel hebben gegeten dat natriumbisulfiet bevat. Er wordt zelfs gezegd dat het hierin vitamine B1 vernietigt.
Internationale gezondheidsorganisaties hebben het gebruik ervan beperkt tot micro-hoeveelheden in voedsel.
Natriumbisulfiet heeft echter vele andere toepassingen, zoals bij het verkrijgen van jodium, als een infectiewerend middel, om weefsels witter te maken, voor de vertering van hout tijdens de bereiding van papierpulp, als ontsmettingsmiddel voor bier- en wijnvaten, enz..
Artikel index
- 1 Chemische structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Dichtheid
- 3.5 Oplosbaarheid
- 3,6 pH
- 3.7 Chemische eigenschappen
- 3.8 Risico's
- 4 Verkrijgen
- 5 toepassingen
- 5.1 In de pulp- en papierindustrie
- 5.2 In de voedingsindustrie
- 5.3 Controverse over het gebruik ervan in voedsel
- 5.4 In landbouwtoepassingen
- 5.5 Bij het verkrijgen van jodium
- 5.6 In de meubel- en houtindustrie
- 5.7 In verschillende toepassingen
- 6 referenties
Chemische structuur
Natriumbisulfiet bestaat uit een natriumkation Na+ en een bisulfietanion HSO3-.
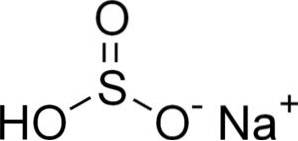
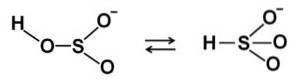
In waterige oplossingen vormt bisulfiet 4 soorten. In verdunde oplossing is er een balans tussen de onderstaande structuren:
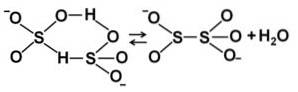
Wanneer de concentratie toeneemt, interageren twee bisulfietmoleculen met elkaar en vormen ze het pyrosulfietion StweeOF5twee-
Nomenclatuur
-Natriumbisulfiet
-Natriumwaterstofsulfiet
-Natriumhydrosulfiet.
Eigendommen
Fysieke toestand
Stevig wit kristallijn.
Molecuulgewicht
104,06 g / mol
Smeltpunt
Het valt uiteen.
Dichtheid
1,48 g / cm3 bij 20 ºC.
Oplosbaarheid
Oplosbaar in water: 29 g / 100 g water.
pH
De oplossingen zijn zuur, met een pH tussen 2,5 en 5,5.
Chemische eigenschappen
In waterige oplossing natriumbisulfiet NaHSO3 scheidt zich in zijn ionen: het natriumkation Na+ en het bisulfietanion HSO3-.
Als natriumbisulfiet wordt blootgesteld aan lucht, verliest het wat SOtwee en oxideert langzaam tot Na-sulfaattweeSW4.
Bij verhitting tot ontbinding, geeft het dampen van zwaveloxiden en natriummonoxide af..
Het is een reductiemiddel, wat het tegenovergestelde is van oxidatiemiddel. En om deze reden kan het zich gedragen als een antioxidant.
Het heeft een lichte geur van zwavel. Het is niet brandbaar.
Risico's
NaHSO natriumbisulfiet3 het is sterk irriterend voor huid en weefsels. Stof irriteert de ogen, neus en keel. Bij inslikken irriteert het de maag. Hoge doses kunnen gewelddadige koliek, diarree, depressie en de dood veroorzaken..
Het is niet brandbaar, maar produceert bij verhitting irriterende en giftige gassen.
Het verkrijgen van
Het wordt bereid door een natriumcarbonaatoplossing Na te verzadigentweeCO3 met zwaveldioxide SOtwee en kristalliseert in oplossing.
Toepassingen
In de pulp- en papierindustrie
De NaHSO3 Het wordt gebruikt bij de vertering van hout, zodat het later papier kan worden. Het dient ook als bleekmiddel.
Het wordt ook gebruikt om chloor te verwijderen als er papierpulp mee is gebleekt..
In de voedingsindustrie
Natriumbisulfiet werkt vanwege zijn reducerende eigenschap als een antioxidant.
Het wordt gebruikt als conserveermiddel in een groot aantal voedingsmiddelen en dranken, waaronder wijn en bier, om bederf te voorkomen en de smaak te verbeteren..
Het wordt gebruikt om voedingsmiddelen, zoals bepaalde eetbare zetmelen, witter te maken.
Het vermindert of voorkomt voedselbederf, maakt het conditioneren van het deeg dat wordt gebruikt in gebakken goederen mogelijk en dient om de maïskorrels te verzachten tijdens nat malen, naast andere toepassingen.
Naast het beheersen van de fermentatie van wijn en bier, werkt het als een antisepticum bij de bereiding ervan, omdat het dient als sterilisator en fungicide in vaten en vaten..

In gedroogd fruit wordt het aangetroffen in concentraties boven 100 ppm (ppm betekent "delen per miljoen"), in veel andere voedingsmiddelen wordt het aangetroffen in concentraties tussen 10 en 100 ppm, zoals bevroren en gedroogde aardappelen, augurken, sauzen en jam..

Controverse over het gebruik ervan in voedsel
Er bestaat enige bezorgdheid over zowel de onmiddellijke als de toxische effecten op lange termijn van natriumbisulfiet in voedsel. De meningen lopen uiteen.
Er zijn meldingen van bijwerkingen bij patiënten met astma, een aandoening van de luchtwegen, na inname van voedsel met NaHSO3. Andere bronnen geven aan dat het bisulfietion vitamine B1 of thiamine kan vernietigen.

Sommige onderzoekers ontdekten echter in 1985 dat natriumbisulfiet dient ter bescherming tegen straling en chemische agentia, en de transformatie van cellen naar kanker remt of verhindert. Lage doses zijn het beste.
Dit beschermende effect is verklaard op basis van zijn reducerende of antioxiderende eigenschappen en dat het op deze manier vrije radicalen zou kunnen aanvallen.
Aan de andere kant, de Wereldgezondheidsorganisatie, of WHO (voor het acroniem in het Engels Wereldgezondheidsorganisatie), adviseert als een aanvaardbaar niveau van dagelijkse inname ongeveer 0,7 mg / kg van het gewicht van de persoon.
Dat betekent dat het wordt aanbevolen om dat bedrag niet te overschrijden..
De Amerikaanse Food and Drug Administration, of USFDA. Amerikaanse Food and Drug Administration), geclassificeerd natriumbisulfiet als 'algemeen erkend als veilig'.
In landbouwtoepassingen
NaHSO gebruikt in lage concentraties3 dient als een plantengroeiregulator, om de fotosynthese te verbeteren en de gewasopbrengst te bevorderen.
Hiervoor is het getest in verschillende plantensoorten, zoals aardbeien- en theeplanten..

Het is het actieve ingrediënt in veel pesticiden en biociden.
In aquatische omgevingen kan het ook de omzetting van bepaalde herbiciden in minder giftige producten versnellen door chloor te elimineren..
Bij het verkrijgen van jodium
De NaHSO3 is de reducerende verbinding die wordt gebruikt om jodium vrij te maken uit natriumjodaat NaIO3. Dit is een van de manieren om jodium te verkrijgen uit bronnen zoals nitro uit Chili of wat zoute wateren.
Na kristallisatie van het natriumnitraat uit de ruwe Chili-nitraatoplossing blijft een NaIO-oplossing over3 die wordt behandeld met natriumbisulfiet NaHSO3, het genereren van gratis jodium.
2 NaIO3 + 5 NaHSO3 → 3 NaHSO4 + NatweeSW4 + iktwee
In de meubel- en houtindustrie
De NaHSO3 Het is getest om soja-eiwitten te modificeren en hun hechtingseigenschappen met hout te verbeteren om stukken hout aan elkaar te lijmen om bijvoorbeeld spaanplaat, karton of papier-maché, multiplex, enz. Voor te bereiden. Dit alles voor meubels of planken, onder verschillende toepassingen.

Dit wordt gedaan om traditionele lijmen op formaldehydebasis te vervangen, omdat ze zowel tijdens hun productieproces als tijdens het gebruik de neiging hebben om formaldehyde af te geven in de atmosfeer, wat een giftige verbinding is..
Natriumbisulfiet verbetert het gehalte aan vaste stoffen van de soja-eiwitkleefstof en verlaagt de viscositeit ervan, waardoor de vloeibaarheid verbetert, zodat het beter in de poriën van het hout doordringt, waardoor de samenhang ermee en tussen de stukken wordt vergroot..
De NaHSO gemodificeerde soja-eiwitlijm3 heeft een goede waterbestendigheid en uitstekende opslagstabiliteit dankzij de antioxiderende werking van natriumbisulfiet.
Dit bevestigt dat NaHSO-gemodificeerde soja-eiwitlijmen3 zijn vergelijkbaar met op formaldehyde gebaseerde lijmen en kunnen worden gebruikt in de meubel- en houtindustrie, omdat ze minder vervuilend zijn.
In verschillende toepassingen
Het heeft meerdere toepassingen, meestal gebaseerd op zijn reducerende eigenschappen (wat het tegenovergestelde is van oxidatiemiddel). Hier zijn enkele toepassingen.
-In de fotografie.
-Bij het looien van leer, om haar van huiden te verwijderen.
-Therapeutisch gebruik: infectiewerend. Het wordt in sommige oogdruppels als antioxidant gebruikt.
-Bij de winning van aardgas door hydrofracturering.
-Bij het kleuren van vezels wordt het gebruikt voor de bereiding van warme of koude baden, om bepaalde kleurstoffen of kleurstoffen op te lossen.
-Als reductiemiddel bij het wassen of bleken, om wol, zijde en plantaardige vezels witter te maken.
-In chemielaboratoria om permanganaatvlekken van huid en kleding te verwijderen. In biochemische laboratoria als conserveermiddel voor vloeistoffen of oplossingen die na verloop van tijd kunnen bederven. Als chemisch reagens.
-Voor het coaguleren van rubberlatex.
-In de cosmetische industrie als antioxidant.
-Ontsmettingsmiddel en bleekmiddel.
-Bij de behandeling van afvalwater om het chloor te verwijderen dat wordt gebruikt in de laatste fase van de desinfectie en om het reeds behandelde water af te voeren naar het milieu.

Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Natriumbisulfiet. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Qi, G. et al. (2013). Hechting en fysisch-chemische eigenschappen van soja-eiwit gemodificeerd door natriumbisulfiet. J Am Oil Chem Soc (2013) 90: 1917-1926. Hersteld van aocs.onlinelibrary.wiley.com.
- Borek, C. et al. (1985). Natriumbisulfiet beschermt tegen radiogene en chemisch geïnduceerde transformatie in hamsterembryo's en C3H / 10T-1/2-cellen van muizen. Toxicol Ind Health 1985Sep; 1 (1): 69-74. Hersteld van journals.sagepub.com.
- Friedler, E. et al. (2015). Een continue actieve monitoringbenadering om kruisverbanden tussen drinkwater- en afvalwaterdistributiesystemen te identificeren. Environ Monit Assess (2015) 187: 131. Opgehaald van link.springer.com.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Sunnyvale Cleanwater-programma. (2019). Masterplan voor beheersing van waterverontreiniging. Opgehaald van sunnyvalecleanwater.com.
- Barros Santos, C. (2008). Additieven in het voedsel van de Spanjaarden en de wetgeving die hun autorisatie en gebruik regelt. Vision Books. Opgehaald van books.google.co.ve.



Niemand heeft nog op dit artikel gereageerd.