
Salpeterzuur (HNO3) structuur, eigenschappen, synthese en toepassingen
De salpeterzuur Het is een anorganische verbinding die bestaat uit een stikstofoxozuur. Het wordt als een sterk zuur beschouwd, hoewel de pKa (-1,4) vergelijkbaar is met de pKa van het hydroniumion (-1,74). Vanaf dit punt is het misschien wel de "zwakste" van veel bekende sterke zuren..
Het fysieke uiterlijk bestaat uit een kleurloze vloeistof die bij opslag verandert in een gelige kleur door de vorming van stikstofgassen. De chemische formule is HNO3.

Het is enigszins onstabiel en ondergaat een lichte ontleding door blootstelling aan zonlicht. Bovendien kan het volledig worden afgebroken door verwarming, waarbij stikstofdioxide, water en zuurstof vrijkomen..
De afbeelding hierboven toont wat salpeterzuur in een maatkolf. De gele verkleuring kan worden opgemerkt, wat wijst op een gedeeltelijke ontbinding.
Het wordt gebruikt bij de vervaardiging van anorganische en organische nitraten, evenals in nitrosoverbindingen die worden gebruikt bij de vervaardiging van meststoffen, explosieven, tussenproducten voor kleurstoffen en verschillende organische chemische verbindingen..
Dit zuur was al bekend bij de alchemisten van de 8e eeuw, die ze “agua fortis” noemden. De Duitse chemicus Johan Rudolf Glauber (1648) ontwierp een methode voor de bereiding ervan, die bestond uit het verhitten van kaliumnitraat met zwavelzuur.
Het wordt industrieel bereid volgens de methode die is ontworpen door Wilhelm Oswald (1901). De methode bestaat in het algemeen uit de katalytische oxidatie van ammonium, met de opeenvolgende vorming van stikstofmonoxide en stikstofdioxide om salpeterzuur te vormen..
In de atmosfeer, NEEtwee geproduceerd door menselijke activiteit reageert met wolkenwater en vormt HNO3. Dan, tijdens zure regen, slaat het samen met waterdruppels neer, waardoor bijvoorbeeld standbeelden op openbare pleinen worden weggevreten..
Salpeterzuur is een zeer giftige verbinding en continue blootstelling aan de dampen kan leiden tot chronische bronchitis en chemische longontsteking..
Artikel index
- 1 Structuur van salpeterzuur
- 1.1 Resonantiestructuren
- 2 Fysische en chemische eigenschappen
- 2.1 Chemische namen
- 2.2 Molecuulgewicht
- 2.3 Fysiek uiterlijk
- 2.4 Geur
- 2.5 Kookpunt
- 2.6 Smeltpunt
- 2.7 Oplosbaarheid in water
- 2.8 Dichtheid
- 2.9 Relatieve dichtheid
- 2.10 Relatieve dampdichtheid
- 2.11 Dampspanning
- 2.12 Ontleding
- 2.13 Viscositeit
- 2.14 Corrosie
- 2.15 Molaire verdampingsenthalpie
- 2.16 Standaard molaire enthalpie
- 2.17 Standaard molaire entropie
- 2.18 Oppervlaktespanning
- 2.19 Geurdrempelwaarde
- 2.20 Dissociatieconstante
- 2.21 Brekingsindex (η / D)
- 2.22 Chemische reacties
- 3 Synthese
- 3.1 Industrieel
- 3.2 In het laboratorium
- 4 toepassingen
- 4.1 Kunstmestproductie
- 4.2 Industrieel
- 4.3 Metaalreiniger
- 4.4 Aqua regia
- 4.5 Meubilair
- 4.6 Reiniging
- 4.7 Fotografie
- 4.8 Andere
- 5 Toxiciteit
- 6 referenties
Salpeterzuur structuur
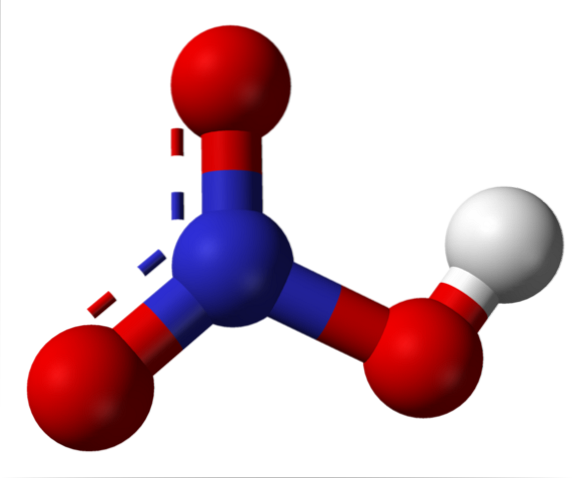
De bovenste afbeelding toont de structuur van een HNO-molecuul.3 met een model van bollen en staven. Het stikstofatoom, de blauwe bol, bevindt zich in het midden, omgeven door een driehoekige vlakke geometrie; de driehoek wordt echter vervormd door een van de langste hoekpunten.
Salpeterzuurmoleculen zijn dan plat. De N = O-, N-O- en N-OH-bindingen vormen de hoekpunten van de platte driehoek. Indien in detail waargenomen, is de N-OH-binding meer langwerpig dan de andere twee (waar de witte bol die het H-atoom vertegenwoordigt, wordt gevonden).
Resonantiestructuren
Er zijn twee bindingen met dezelfde lengte: N = O en N-O. Dit feit druist in tegen de valentiebindingstheorie, waarbij wordt voorspeld dat dubbele bindingen korter zijn dan enkele bindingen. De verklaring hiervoor ligt in het fenomeen resonantie, zoals te zien is in onderstaande afbeelding.

Beide bindingen, N = O en N-O, zijn daarom equivalent in termen van resonantie. Dit wordt grafisch weergegeven in het structuurmodel door middel van een stippellijn tussen twee O-atomen (zie structuur).
Wanneer HNO wordt gedeprotoneerd3, het stabiele anion nitraat NO wordt gevormd3-. Daarin omvat de resonantie nu alle drie de O-atomen. Dit is de reden waarom HNO3 heeft een hoge Bronsted-Lowry-zuurgraad (H-ionendonorsoort+.
Fysische en chemische eigenschappen
Chemische namen
-Salpeterzuur
-Azotzuur
-Waterstofnitraat
-Fortis water.
Molecuulgewicht
63.012 g / mol.
Fysiek uiterlijk
Kleurloze of lichtgele vloeistof, die roodbruin kan worden.
Geur
Scherpe, verstikkende eigenschap.
Kookpunt
181ºF tot 760 mmHg (83ºC).
Smeltpunt
-41,6 ºC.
Oplosbaarheid in water
Zeer oplosbaar en mengbaar met water.
Dichtheid
1.513 g / cm3 bij 20 ºC.
Relatieve dichtheid
1,50 (in relatie tot water = 1).
Relatieve dampdichtheid
2 of 3 keer geschat (in relatie tot lucht = 1).
Dampdruk
63,1 mmHg bij 25 ºC.
Ontleding
Bij blootstelling aan luchtvochtigheid of hitte kan het ontleden en stikstofperoxide vormen. Bij verhitting tot ontbinding, geeft het een zeer giftige rook van stikstofoxide en waterstofnitraat af..
Salpeterzuur is niet stabiel, kan in contact met hitte en blootstelling aan zonlicht ontleden en stikstofdioxide, zuurstof en water uitstoten..
Viscositeit
1092 mPa bij 0 ° C en 0,617 mPa bij 40 ° C.
Corrosie
Het kan alle basismetalen aantasten, behalve aluminium en chroomstaal. Tast sommige soorten kunststoffen, rubbers en coatings aan. Het is een bijtende en bijtende stof, dus u moet er uiterst voorzichtig mee omgaan.
Molaire verdampingsenthalpie
39,1 kJ / mol bij 25 ºC.
Standaard molaire enthalpie
-207 kJ / mol (298 ºF).
Standaard molaire entropie
146 kJ / mol (298 ºF).
Oppervlaktespanning
-0,04356 N / m bij 0 ºC
-0,04115 N / m bij 20 ºC
-0,0376 N / m bij 40 ºC
Geurdrempel
-Weinig geur: 0,75 mg / m3
-Sterke geur: 250 mg / m3
-Irriterende concentratie: 155 mg / m3.
Dissociatieconstante
pKa = -1,38.
Brekingsindex (η / D)
1.393 (16.5 ºC).
Chemische reacties
Hydratatie
-Kan vaste hydraten vormen, zoals HNO3∙ HtweeO en HNO3∙ 3HtweeOf: "salpeterijs".
Dissociatie in water
Salpeterzuur is een sterk zuur dat als volgt snel ioniseert in water:
HNO3 (l) + HtweeO (l) => H3OF+ (ac) + NO3-
Zoutvorming
Reageert met basische oxiden om een nitraatzout en water te vormen.
CaO ('s) + 2 HNO3 (l) => Ca (NO3twee (ac) + HtweeO (l)
Evenzo reageert het met basen (hydroxiden) en vormt het een zout van nitraat en water..
NaOH (aq) + HNO3 (l) => NaNO3 (ac) + HtweeO (l)
En ook met carbonaten en zuurcarbonaten (bicarbonaten), die ook kooldioxide vormen.
NatweeCO3 (ac) + HNO3 (l) => NaNO3 (ac) + HtweeO (l) + COtwee (g)
Protonering
Salpeterzuur kan zich ook als basis gedragen. Om deze reden kan het reageren met zwavelzuur.
HNO3 + 2HtweeSW4 <=> NIETtwee+ + H.3OF+ + 2HSO4-
Autoprotolyse
Salpeterzuur ondergaat autoprotolyse.
2HNO3 <=> NIETtwee+ + NIET3- + H.tweeOF
Metaaloxidatie
In de reactie met metalen gedraagt salpeterzuur zich niet als sterke zuren, die reageren met metalen, het overeenkomstige zout vormen en waterstof in gasvorm vrijgeven..
Magnesium en mangaan reageren echter heet met salpeterzuur, net als de andere sterke zuren..
Mg (s) + 2 HNO3 (l) => Mg (NO3twee (ac) + Htwee (g)
Andere
Salpeterzuur reageert met metaalsulfieten om een nitraatzout, zwaveldioxide en water te vormen..
NatweeSW3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SOtwee (g) + HtweeO (l)
En het reageert ook met organische verbindingen, waarbij een waterstof wordt vervangen door een nitrogroep; vormt daarmee de basis voor de synthese van explosieve verbindingen zoals nitroglycerine en trinitrotolueen (TNT).
Synthese
Industrieel
Het wordt op industrieel niveau geproduceerd door katalytische oxidatie van ammonium, volgens de methode beschreven door Oswald in 1901. De procedure bestaat uit drie fasen of stappen.
Fase 1: oxidatie van ammonium tot stikstofoxide
Ammoniak wordt geoxideerd door zuurstof in de lucht. De reactie wordt uitgevoerd bij 800 ° C en onder een druk van 6-7 atm, met gebruik van platina als katalysator. Ammoniak wordt gemengd met lucht in de volgende verhouding: 1 volume ammoniak per 8 volumes lucht.
4NH3 (g) + 50twee (g) => 4NO (g) + 6HtweeO (l)
Bij de reactie wordt stikstofmonoxide geproduceerd, dat voor de volgende stap naar de oxidatiekamer wordt gebracht..
Stap 2. Oxidatie van stikstofmonoxide tot stikstofdioxide
De oxidatie wordt uitgevoerd door de zuurstof die in de lucht aanwezig is bij een temperatuur lager dan 100 ºC.
2NO (g) + Otwee (g) => 2NOtwee (g)
Stap 3. Oplossen van stikstofdioxide in water
In deze fase vindt de vorming van salpeterzuur plaats.
4 NEEtwee + 2HtweeO + Otwee => 4HNO3
Er zijn verschillende methoden voor de opname van stikstofdioxide (NOtwee) in water.
Onder andere methoden: NEEtwee wordt gedimeriseerd tot NtweeOF4 bij lage temperaturen en hoge druk, om de oplosbaarheid in water te vergroten en salpeterzuur te produceren.
3NtweeOF4 + 2HtweeO => 4HNO3 + 2 NEE
Het salpeterzuur dat wordt geproduceerd door de oxidatie van ammoniak heeft een concentratie tussen 50-70%, die op 98% kan worden gebracht door geconcentreerd zwavelzuur als dehydratatiemiddel te gebruiken, waardoor de concentratie van salpeterzuur kan worden verhoogd..
Op het laboratorium
Thermische ontleding van koper (II) nitraat, waarbij stikstofdioxide en zuurstofgassen worden geproduceerd, die door water worden geleid om salpeterzuur te vormen; zoals in de Oswald-methode, eerder beschreven.
2Cu (GEEN3twee => 2CuO + 4NOtwee + OFtwee
Reactie van een nitraatzout met HtweeSW4 geconcentreerd. Het gevormde salpeterzuur wordt gescheiden van de HtweeSW4 door destillatie bij 83 ºC (kookpunt van salpeterzuur).
KNO3 + H.tweeSW4 => HNO3 + KHSO4
Toepassingen
Kunstmestproductie
60% van de productie van salpeterzuur wordt gebruikt bij de vervaardiging van meststoffen, met name ammoniumnitraat.
Dit kenmerkt zich door de hoge concentratie stikstof, een van de drie belangrijkste voedingsstoffen voor planten, nitraat wordt direct door de planten gebruikt. Ondertussen wordt ammoniak geoxideerd door de micro-organismen die in de bodem aanwezig zijn en wordt het gebruikt als meststof voor de lange termijn..
Industrieel
-15% van de salpeterzuurproductie wordt gebruikt bij de vervaardiging van synthetische vezels.
-Het wordt gebruikt bij de productie van salpeterzuuresters en nitro-derivaten; zoals nitrocellulose, acrylverf, nitrobenzeen, nitrotolueen, acrylonitrilen, etc..
-Het kan nitrogroepen toevoegen aan organische verbindingen, en deze eigenschap kan worden gebruikt om explosieven te maken, zoals nitroglycerine en trinitrotolueen (TNT)..
-Adipinezuur, een voorloper van nylon, wordt op grote schaal geproduceerd door oxidatie van cyclohexanon en cyclohexanol door salpeterzuur..
Metalen Purifier
Salpeterzuur is vanwege zijn oxiderende capaciteit erg nuttig bij de zuivering van metalen die in mineralen aanwezig zijn. Evenzo wordt het gebruikt bij het verkrijgen van elementen zoals uranium, mangaan, niobium, zirkonium en bij het aanzuren van fosforgesteenten om fosforzuur te verkrijgen..
Koninklijk water
Het wordt gemengd met geconcentreerd zoutzuur om "aqua regia" te vormen. Deze oplossing kan goud en platina oplossen, waardoor het kan worden gebruikt bij de zuivering van deze metalen..
Meubilair
Salpeterzuur wordt gebruikt om een antiek effect te verkrijgen in meubels gemaakt van grenenhout. Behandeling met een 10% salpeterzuuroplossing geeft een grijs-gouden kleur in het hout van de meubelen.
Schoonmaak
-Het mengsel van waterige oplossingen van salpeterzuur 5-30% en fosforzuur 15-40% wordt gebruikt bij het reinigen van de apparatuur die wordt gebruikt bij het melken, om de residuen van de precipitaten van de magnesium- en calciumverbindingen te verwijderen.
-Het is handig bij het reinigen van glaswerk dat in het laboratorium wordt gebruikt.
Fotografie
-Salpeterzuur is in de fotografie gebruikt, met name als additief voor ijzersulfaatontwikkelaars in het natte plaatproces, om een wittere kleur in ambrotypen en tintypes te bevorderen..
-Het werd gebruikt om de pH van het zilverbad van de collodiumplaten te verlagen, waardoor het uiterlijk van een nevel die de beelden verstoorde, verminderde..
Anderen
-Vanwege zijn oplosmiddelcapaciteit wordt het gebruikt bij de analyse van verschillende metalen door middel van vlamatoomabsorptiespectrofotometrie-technieken en inductief gekoppelde plasmamassaspectrofotometrie..
-De combinatie van salpeterzuur en zwavelzuur werd gebruikt voor de omzetting van gewone katoen in cellulosenitraat (salpeter katoen).
-Het medicijn Salcoderm voor uitwendig gebruik wordt gebruikt bij de behandeling van goedaardige neoplasmata van de huid (wratten, likdoorns, condylomen en papillomen). Het bezit eigenschappen van cauterisatie, verlichting van pijn, irritatie en jeuk. Salpeterzuur is het hoofdbestanddeel van de medicijnformule.
-Rood rokend salpeterzuur en wit rokend salpeterzuur worden gebruikt als oxidatiemiddelen voor vloeibare raketbrandstoffen, vooral in de BOMARC-raket..
Toxiciteit
-Bij contact met de huid kan het brandwonden, ernstige pijn en dermatitis veroorzaken..
-In contact met de ogen kan het ernstige pijn, tranen en in ernstige gevallen hoornvliesbeschadiging en blindheid veroorzaken..
-Inademing van de dampen kan hoesten, ademnood, neusbloedingen, laryngitis, chronische bronchitis, longontsteking en longoedeem veroorzaken bij ernstige of chronische blootstelling..
-Door de opname zijn er laesies in de mond, speekselvloed, intense dorst, pijn bij het slikken, intense pijn door het hele spijsverteringskanaal en het risico op perforatie van de wand ervan..
Referenties
- Wikipedia. (2018). Salpeterzuur. Hersteld van: en.wikipedia.org
- PubChem. (2018). Salpeterzuur. Hersteld van: pubchem.ncbi.nlm.nih.gov
- De redactie van Encyclopaedia Britannica. (23 november 2018). Salpeterzuur. Encyclopædia Britannica. Hersteld van: britannica.com
- Shrestha B. (s.f.). Eigenschappen van salpeterzuur en toepassingen. Chem Guide: tutorials voor het leren van scheikunde. Hersteld van: chem-guide.blogspot.com
- Chemisch boek. (2017). Salpeterzuur. Hersteld van: chemicalbook.com
- Imanol. (10 september 2013). Salpeterzuurproductie. Hersteld van: ingenieriaquimica.net



Niemand heeft nog op dit artikel gereageerd.