
Structuur, eigenschappen en toepassingen van periodiek zuur (HIO4)

De periodiek zuur het is een oxacid, wat overeenkomt met oxidatietoestand VII van jodium. Het bestaat in twee vormen: de orthoperiodische (H.5IO6) en metaperjoodzuur (HIO4Het werd in 1838 ontdekt door de Duitse chemici H. G. Magnus en C. F. Ammermüller.
In verdunde waterige oplossingen komt perjoodzuur voornamelijk voor in de vorm van metaperjoodzuur en hydroniumion (H3OF+Ondertussen verschijnt in geconcentreerde waterige oplossingen perjoodzuur als orthoperiodinezuur..

Beide vormen van perjoodzuur zijn aanwezig in een dynamisch chemisch evenwicht, waarbij de overheersende vorm afhankelijk is van de pH die in de waterige oplossing aanwezig is..
De bovenste afbeelding toont orthoperiodinezuur, dat bestaat uit kleurloze hygroscopische kristallen (om die reden zien ze er nat uit). Hoewel de formules en structuren tussen de H5IO6 en HIO4 zijn op het eerste gezicht heel verschillend, de twee houden rechtstreeks verband met de mate van hydratatie.
De H5IO6 kan worden uitgedrukt als HIO4∙ 2HtweeOf, en daarom moet je het uitdrogen om de HIO te krijgen4hetzelfde gebeurt in de tegenovergestelde richting, bij het hydrateren van de HIO4 de H wordt geproduceerd5IO6.
Artikel index
- 1 Structuur van perjoodzuur
- 1.1 Orthoperiodic zuur
- 2 Eigenschappen
- 2.1 Molecuulgewichten
- 2.2 Fysiek uiterlijk
- 2.3 Smeltpunt
- 2.4 Vlampunt
- 2.5 Stabiliteit
- 2,6 pH
- 2.7 Reactiviteit
- 3 Nomenclatuur
- 3.1 Traditioneel
- 3.2 Systematiek en voorraad
- 4 toepassingen
- 4.1 Artsen
- 4.2 In het laboratorium
- 5 referenties
Structuur van perjoodzuur
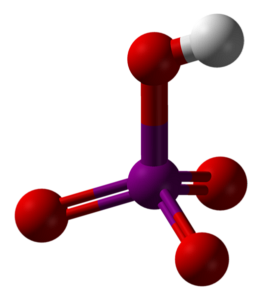
De bovenste afbeelding toont de moleculaire structuur van metaperiodinezuur, HIO4. Dit is de vorm die het meest wordt uitgelegd in scheikundeteksten; het is echter het minst thermodynamisch stabiel.
Zoals te zien is, bestaat het uit een tetraëder met in het midden het jodiumatoom (paarse bol) en de zuurstofatomen (rode bolletjes) bij zijn hoekpunten. Drie van de zuurstofatomen vormen een dubbele binding met jodium (I = O), terwijl een van hen een enkele binding vormt (I-OH).
Dit molecuul is zuur vanwege de aanwezigheid van de OH-groep, die een H-ion kan doneren+en zelfs nog meer wanneer de positieve gedeeltelijke lading van H groter is vanwege de vier zuurstofatomen die aan het jodium zijn gebonden. Merk op dat de HIO4 kan vier waterstofbruggen vormen: één door de OH (doneert) en drie door zijn zuurstofatomen (accepteert).
Kristallografische studies hebben aangetoond dat jodium in feite twee zuurstofatomen van een naburig HIO-molecuul kan accepteren.4. Daarbij worden twee octaëders IO verkregen6, verbonden door twee I-O-I-bindingen in cis-posities; dat wil zeggen, ze bevinden zich aan dezelfde kant en zijn niet gescheiden door een hoek van 180 °.
Deze octaëders IO6 ze zijn zo met elkaar verbonden dat ze oneindige ketens vormen, dat ze bij interactie met elkaar het HIO-kristal 'bewapenen'4.
Orthoperiodic zuur
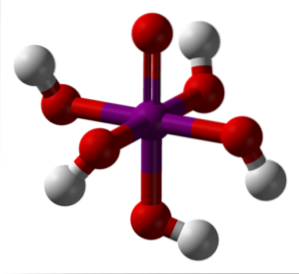
De afbeelding hierboven toont de meest stabiele en gehydrateerde vorm van perjoodzuur: orthoperiodisch, H.5IO6. De kleuren voor dit model van staven en bollen zijn dezelfde als voor de HIO4 net uitgelegd. Hier kun je direct zien hoe een octaëder IO eruit ziet6.
Merk op dat er vijf OH-groepen zijn, die overeenkomen met de vijf H-ionen+ dat zou theoretisch het H-molecuul kunnen vrijgeven5IO6. Vanwege de toenemende elektrostatische afstoting kan het echter slechts drie van die vijf vrijgeven, waardoor verschillende dissociatie-evenwichten tot stand worden gebracht..
Deze vijf OH-groepen laten H toe5IO6 accepteren verschillende watermoleculen, en daarom zijn de kristallen ervan hygroscopisch; dat wil zeggen, ze absorberen het vocht dat in de lucht aanwezig is. Deze zijn ook verantwoordelijk voor het aanzienlijk hoge smeltpunt voor een verbinding van covalente aard..
Moleculen van H.5IO6 ze vormen veel waterstofbruggen met elkaar en bieden daarom een zodanige directionaliteit dat ze ook in een geordende ruimte kunnen worden gerangschikt. Als resultaat van genoemde ordening, de H5IO6 vormt monokliene kristallen.
Eigendommen
Molecuulgewichten
-Metaperjoodzuur: 190,91 g / mol.
-Orthoperiodic zuur: 227,941 g / mol.
Fysiek uiterlijk
Witte of lichtgele vaste stof, voor HIO4, of kleurloze kristallen, voor H5IO6.
Smeltpunt
128 ºC (263,3 ºF, 401,6 ºF).
Ontstekingspunt
140 ºC.
Stabiliteit
Stal. Sterk oxidatiemiddel. Contact met brandbare materialen kan brand veroorzaken. Hygroscopisch. Onverenigbaar met organische materialen en sterke reductiemiddelen.
pH
1.2 (oplossing van 100 g / l water van 20 ºC).
Reactiviteit
Periodiek zuur is in staat om de binding te verbreken van vicinale diolen die aanwezig zijn in koolhydraten, glycoproteïnen, glycolipiden, enz., Afkomstig van moleculaire fragmenten met terminale groepen aldehyden.
Deze eigenschap van perjoodzuur wordt gebruikt om de structuur van koolhydraten te bepalen, evenals de aanwezigheid van stoffen die verband houden met deze verbindingen..
De aldehyden die door deze reactie worden gevormd, kunnen reageren met het reagens van Schiff en de aanwezigheid van complexe koolhydraten detecteren (ze worden paars). Periodiek zuur en Schiff's reagens worden gekoppeld aan een reagens dat wordt afgekort als PAS.
Nomenclatuur
Traditioneel
Perjoodzuur heeft zijn naam omdat jodium werkt met de hoogste van zijn valenties: +7, (VII). Dit is de manier om het te benoemen volgens de oude nomenclatuur (de traditionele).
In scheikundeboeken plaatsen ze altijd de HIO4 als de enige vertegenwoordiger van perjoodzuur, synoniem met metaperjoodzuur.
Metaperjoodzuur dankt zijn naam aan het feit dat jodiumanhydride reageert met een watermolecuul; dat wil zeggen, de mate van hydratatie is het laagst:
iktweeOF7 + H.tweeO => 2HIO4
Terwijl voor de vorming van orthoperiodic zuur, de ItweeOF7 moet reageren met een grotere hoeveelheid water:
iktweeOF7 + 5HtweeO => 2H5IO6
Reageren met vijf watermoleculen in plaats van één.
De term ortho-, wordt uitsluitend gebruikt om naar de H te verwijzen5IO6, en daarom verwijst periodiek zuur alleen naar HIO4.
Systematiek en voorraad
Andere, minder gebruikelijke namen voor perjoodzuur zijn:
-waterstoftetraoxoiodaat (VII).
-Tetraoxojoodzuur (VII)
Toepassingen
Artsen
Paarse PAS-vlekken verkregen door de reactie van perjoodzuur met koolhydraten worden gebruikt bij de bevestiging van glycogeenstapelingsziekte; bijvoorbeeld de ziekte van Von Gierke.
Ze worden gebruikt bij de volgende medische aandoeningen: de ziekte van Paget, sarcoom van het zachte deel van het gezichtsvermogen, detectie van lymfocytaggregaten in mycosis fungoides en het Sezany-syndroom.
Ze worden ook gebruikt bij de studie van erythroleukemie, een onrijpe rode bloedcelleukemie. Cellen kleuren heldere fuchsia. Bovendien worden infecties met levende schimmels gebruikt in het onderzoek, waardoor de wanden van de schimmels een magenta kleur krijgen.
Op het laboratorium
-Het wordt naast de organische synthese ook gebruikt bij de chemische bepaling van mangaan.
-Perjoodzuur wordt gebruikt als een selectief oxidatiemiddel op het gebied van organische chemische reacties..
-Periodiek zuur kan de afgifte van aceetaldehyde en hogere aldehyden veroorzaken. Bovendien kan perjoodzuur formaldehyde afgeven voor detectie en isolatie, evenals het vrijkomen van ammoniak uit hydroxyaminozuren..
-Periodieke zuuroplossingen worden gebruikt bij de studie van de aanwezigheid van aminozuren met OH- en NH-groepen.twee in aangrenzende posities. Een perjoodzuuroplossing wordt gebruikt in combinatie met kaliumcarbonaat. In dit opzicht is serine het eenvoudigste hydroxyaminozuur.
Referenties
- Gavira José M Vallejo. (24 oktober 2017). Betekenis van de meta-, pyro- en ortho-voorvoegsels in de oude nomenclatuur. Hersteld van: triplenlace.com
- Gunawardena G. (17 maart 2016). Periodiek zuur. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- Wikipedia. (2018). Periodiek zuur. Hersteld van: en.wikipedia.org
- Kraft, T. en Jansen, M. (1997), Kristalstructuurbepaling van metaperiodinezuur, HIO4, met gecombineerde röntgen- en neutronendiffractie. Angew. Chem. Int. Ed. Engl., 36: 1753-1754. doi: 10.1002 / anie.199717531
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Martin, A. J., & Synge, R. L. (1941). Enkele toepassingen van perjoodzuur bij de studie van de hydroxyaminozuren van eiwithydrolysaten: het vrijkomen van aceetaldehyde en hogere aldehyden door perjoodzuur. 2. Detectie en isolatie van formaldehyde dat wordt vrijgemaakt door perjoodzuur. 3. Ammoniak afgesplitst van hydroxyaminozuren door perjoodzuur. 4. De hydroxyaminozuurfractie van wol. 5 .; Hydroxylysine 'met een bijlage door Florence O. Bell Textile Physics Laboratory, University of Leeds. Het biochemische tijdschrift, 35(3), 294-314.1.
- Asima. Chatterjee en S. G. Majumdar. (1956). Gebruik van periodiek zuur voor het opsporen en lokaliseren van ethylenische onverzadiging. Analytical Chemistry 1956 28 (5), 878-879. DOI: 10.1021 / ac60113a028.
Niemand heeft nog op dit artikel gereageerd.