
Sulfanilzuurstructuur, eigenschappen, synthese, gebruik

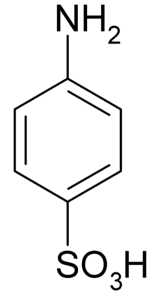
De sulfanilzuur is een kristallijne verbinding waarvan het molecuul wordt gevormd door een benzeenring waaraan een basische groep (-NHtwee) en een zuurgroep (-SO3H). De chemische formule is NHtweeC6H.4SW3H..
Het is ook bekend als 4-aminobenzeensulfonzuur. Het wordt bereid door sulfonering van aniline in de parapositie. De kristallen zijn wit of grijsachtig wit. Het gedrag is meer vergelijkbaar met dat van een zout dan dat van een organische verbinding met NH-groepentwee beer3H. Daarom is het onoplosbaar in de meeste organische oplosmiddelen.
Een van de belangrijkste toepassingen is bij de synthese van kleurstoffen, omdat het gemakkelijk een diazoverbinding vormt die een grondstof is voor deze toepassing..
Zowel sulfanilzuur als zijn derivaten zijn gebruikt als antibacteriële middelen. Het wordt gebruikt bij de synthese van mucolytische verbindingen, omdat ze de viscositeit van slijm of zeer viskeuze biologische vloeistoffen kunnen verlagen..
Het wordt ook gebruikt in de papierindustrie en in formules voor gravures of litho's. Het maakt deel uit van de harsen die worden gebruikt in beton- of mortelmengsels om ze gedurende lange tijd hun vloeibaarheid te laten behouden, zonder de uiteindelijke uithardingstijd te beïnvloeden.
Het is een xenobiotische metaboliet, dit betekent dat het niet van nature door levende wezens wordt aangemaakt. Het is irriterend voor de huid, ogen en slijmvliezen. Bovendien kan het het milieu vervuilen.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Dichtheid
- 3.5 Oplosbaarheid
- 3.6 Chemische eigenschappen
- 3.7 Overige eigendommen
- 4 Synthese
- 5 toepassingen
- 5.1 In de kleurstofindustrie
- 5.2 In analytische chemie
- 5.3 In de geneeskunde als antibacterieel middel
- 5.4 In de geneeskunde als mucolytisch middel
- 5.5 In bioassaylaboratoria
- 5.6 In de papierindustrie
- 5.7 In prenten, gravures of litho's
- 5.8 In bouwmaterialen
- 6 referenties
Structuur
Sulfanilzuur heeft witte kristallen gevormd door orthorhombische of monokliene platen. Het monohydraat kristalliseert in water in de vorm van orthorhombische platen. Als de kristallisatie zeer langzaam verloopt, kristalliseert het dihydraat. Het monohydraat wordt watervrij als het bijna 100 ºC is.
Nomenclatuur
- Sulfanilzuur.
- P-Aminobenzeensulfonzuur.
- 4-Aminobenzeensulfonzuur.
Eigendommen
Fysieke toestand
Witte of gebroken witte kristallijne vaste stof.
Molecuulgewicht
173,19 g / mol.
Smeltpunt
Het ontleedt bij ongeveer 288ºC zonder te smelten. Het wordt ook gerapporteerd bij> 320 ºC.
Dichtheid
1,49 g / cm3
Oplosbaarheid
Bijna onoplosbaar in water: 10,68 g / l bij 20 ºC.
Onoplosbaar in ethanol, benzeen en ether. Enigszins oplosbaar in hete methanol.
Oplosbaar in waterige oplossingen van basen. Onoplosbaar in waterige oplossingen van minerale zuren. Oplosbaar in geconcentreerd zoutzuur.
Chemische eigenschappen
De eigenschappen verschillen van die van andere amino- of gesulfoneerde verbindingen en zijn vergelijkbaar met die van een zout. Dit komt omdat de structuur feitelijk de -NH-groepen bevat3+ En dus3-, waardoor het zwitterionische kenmerken heeft.
Het bevat een zuurgroep en een basische groep op tegenovergestelde polen van hetzelfde molecuul. Maar het waterstofion is gebonden aan stikstof in plaats van zuurstof omdat de -NH-groeptwee is een sterkere basis dan de -SO-groep3-.
Omdat het een zwitterion is, heeft het een hoog smeltpunt en is het onoplosbaar in organische oplosmiddelen..
Sulfanilzuur is oplosbaar in alkalische oplossing omdat het hydroxide-ion OH-, omdat het sterk basisch is, begint het een waterstofion (H.+) van de zwakke basisgroep -NHtwee, het vormen van het p-aminobenzeensulfonaat-ion, dat oplosbaar is in water.
In zuuroplossing verandert de structuur van sulfanilzuur niet, daarom blijft het onoplosbaar.
Andere eigenschappen
Bij verhitting tot ontbinding geeft het giftige dampen van stikstofoxiden en zwavel af.
Blootstelling aan sulfanilzuur kan leiden tot symptomen zoals irritatie van de huid, ogen en slijmvliezen. Het is een bijtende verbinding.
Synthese
Het wordt bereid door aniline te laten reageren met zwavelzuur (H.tweeSW4) bij hoge temperaturen. Aanvankelijk wordt het zure aniliniumsulfaatzout gevormd, dat bij verhitting tot 180-200 ºC wordt gereorganiseerd om de gesubstitueerde ring in de parapositie te vormen, aangezien dit het meest stabiele product is..
Om het met een hoge zuiverheidsgraad te bereiden, de sulfonering van een mengsel van aniline en sulfolaan met HtweeSW4 bij 180-190 ºC.
Toepassingen
In de kleurstofindustrie
Sulfanilzuur wordt gebruikt bij de synthese of bereiding van verschillende kleurstoffen, zoals methyloranje en tartrazine. Hiervoor wordt het gediazoteerd, waarbij gediazoteerd sulfanilzuur wordt gegenereerd..
Het is belangrijk op te merken dat tartrazine is gebruikt als kleurstof in voedsel. Maar eenmaal ingenomen, genereert het bepaalde metabolieten in het menselijk lichaam, waaronder sulfanilzuur, die mogelijk verantwoordelijk zijn voor de vorming van reactieve zuurstofsoorten. Deze kunnen nier- (nieren) of lever- (lever) weefsels aantasten..

In analytische chemie
Het wordt gebruikt als reagens bij de bepaling van verschillende chemische verbindingen, waaronder nitrieten..
In de geneeskunde als antibacterieel middel
Sulfanilamide, afgeleid van sulfanilzuur, wordt toegepast in de farmaceutische industrie omdat het antibacteriële werking heeft.
In het menselijk lichaam verwarren bacteriën het met p-aminobenzoëzuur, een essentiële metaboliet. Deze vervanging betekent dat de bacteriën zich niet voortplanten en afsterven.
Een ander derivaat van sulfanilzuur, verkregen door condensatie met andere verbindingen, heeft ook antibacteriële eigenschappen, die zijn gebaseerd op het vermogen om foliumzuur (een lid van het vitamine B-complex) te verdringen..
Deze verbinding kan oraal worden ingenomen, intraveneus worden geïnjecteerd of uitwendig in een zalf worden aangebracht..
In de geneeskunde als een mucolytisch middel
Er is een derivaat van sulfanilzuur gebruikt dat mucolytische activiteit heeft. Dit is dat het een liquefactieve activiteit van het slijm vertoont, om het slijm zelf of zeer stroperige biologische vloeistoffen op te lossen.
De verbinding kan worden gebruikt voor het vloeibaar maken van slijm dat door een weefsel wordt geproduceerd als gevolg van pathologische aandoeningen. Bijvoorbeeld verstopping van de luchtwegen of die van het vaginale kanaal.
Als het gaat om het vloeibaar maken van slijm in de luchtwegen, wordt het product toegediend door inademing, neusdruppels, nevel, spuitbussen of vernevelaars. Het is een behandeling die toepasbaar is op mensen of zoogdieren. Het is een krachtigere verbinding dan die op basis van cysteïne.

Het wordt ook in het laboratorium gebruikt wanneer het gewenst is om de viscositeit van biologische vloeistoffen te verlagen om analytische bepalingen te vergemakkelijken..
In bioanalyselaboratoria
Gediazoteerd sulfanilzuur (een derivaat bereid door sulfanilzuur te laten reageren met natriumnitriet) wordt gebruikt bij de bepaling van bilirubine.
Bilirubine is een geel pigment dat in gal wordt aangetroffen. Overtollig bilirubine in het bloed is een gevolg van leveraandoeningen, hematologische (of bloed) aandoeningen of aandoeningen van de galwegen.
Om de hoeveelheid bilirubine in het bloed te meten, wordt de diazo afgeleid van sulfanilzuur omgezet met bilirubine om het azobilirubinecomplex te vormen, waarvan de intensiteit wordt gemeten met een colorimeter of spectrofotometer. Op deze manier wordt het bilirubinegehalte in bloedserum bepaald..
In de papierindustrie
Sulfanilzuur maakt het mogelijk om een papierpoetsmiddel te synthetiseren, dat wil zeggen een verbinding die het een optische glans of een wit uiterlijk geeft, omdat het de gele kleur van natuurlijk of onbehandeld papier neutraliseert..

Het heeft het voordeel ten opzichte van andere verbindingen doordat het in relatief hoge concentraties kan worden gebruikt om papierpulp onder lage pH-omstandigheden te behandelen, zonder de geelheid van het papier te vergroten..
Het resultaat is duidelijk wanneer het papier wordt waargenomen met UV (ultraviolet) licht, waaronder het veel meer fluoresceert dan wanneer andere verbindingen worden gebruikt, en met zichtbaar licht wordt waargenomen dat de mate van geelheid erg laag is..
Het is zeer oplosbaar in water, waardoor het in meer geconcentreerde oplossingen kan worden gebruikt. Kan op elk type papier worden gebruikt, inclusief papier dat is gemaakt van gemalen houtpulp, sulfietpulp of elk ander proces.
In prenten, gravures of litho's
Sulfanilzuur werkt als een zuurteregelaar in geconcentreerde oplossingen voor lithografie, zonder de problemen van andere zuren zoals fosforzuur op te leveren, omdat het minder giftig en minder vervuilend is dan de laatste..
In bouwmaterialen
Met sulfanilzuur gemodificeerde waterige melamine-formaldehydeharsoplossingen zijn getest in beton (beton), mortel of cementpasta. Het doel was om het watergehalte te verminderen en een afname van de vloeibaarheid van het mengsel in de loop van de tijd te voorkomen, zonder de hardingstijd te verkorten..
Beton of mortel bereid met deze oplossingen is zeer effectief in de zomer, wanneer de afname van de vloeibaarheid in de loop van de tijd een probleem is..
Met deze oplossingen kan, als de mortel of het beton wordt voorbereid en om welke reden dan ook met rust worden gelaten, de cementsamenstelling gemakkelijk in mallen of dergelijke worden gegoten, aangezien deze na verloop van tijd geen vloeibaarheid heeft verloren..

Referenties
- Windholz, M. et al. (redactie) (1983). De Merck Index. Een encyclopedie van chemicaliën, medicijnen en biologische producten. Tiende editie. Merck & CO., Inc.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Deel 2. Vierde editie. John Wiley & Sons.
- Nationale bibliotheek van geneeskunde. (2019). Sulfanilzuur. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Urist, H. en Martin, G.J. (1950). Sulfanilzuurderivaten. Amerikaans octrooi nr. 2.504.471. Overdragers van The National Drug Company. 18 april 1950.
- Villaume, Frederick G. (1964). Witmakersamenstelling voor papier afgeleid van methanilzuur en sulfanilzuur. Amerikaans octrooi nr. 3.132.106. 5 mei 1964.
- Martin, Tellis A. en Comer, William T. (1979). Benzoëzuurderivaat en benzeensulfonzuur mucolytisch proces. Amerikaans octrooi nr. 4.132.802. 2 januari 1979.
- Druker, L.J. en Kincaid, R.B. (1979). Lithografisch fonteinconcentraat. Amerikaans octrooi nr. 4.150.996. 24 april 1979.
- Shull, Bruce C. (1983). Bilirubine-test. Amerikaans octrooischrift nr. 4.404.286. 13 september 1983.
- Uchida, J. et al .; (2001). Werkwijze voor het bereiden van een waterige oplossing van met sulfanilzuur gemodificeerde melamine-formaldehydehars en een cementsamenstelling. Amerikaans octrooi nr. 6.214.965 B1. 10 april 2001.
- Corradini, M.G. (2019). Deel 1. In Encyclopedia of Food Chemistry. Opgehaald van sciencedirect.com.


Niemand heeft nog op dit artikel gereageerd.