
Sulfaminezuurstructuur, eigenschappen, synthese, gebruik

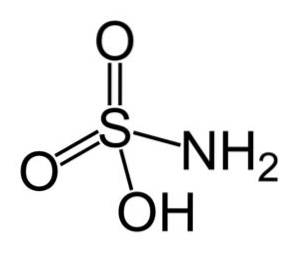
De sulfaminezuur is een anorganische verbinding gevormd door een zwavelatoom (S) covalent gebonden en door een enkele binding aan een hydroxylgroep (-OH) en aan een aminogroep (-NHtwee), en door dubbele binding aan twee zuurstofatomen (O). Het is een witte kristallijne vaste stof. De chemische formule is NHtweeSW3H. Ook bekend als aminosulfonzuur, amidosulfonzuur, amidosulfonzuur en sulfamidezuur..
Sulfaminezuur is een sterk zuur. Het kan reageren met metalen, metaaloxiden en carbonaten. De zouten zijn over het algemeen oplosbaar in water, waardoor het een goede kalkverwijderaar in procesapparatuur is. Het wordt vaak gebruikt in suikermolens om carbonaatafzettingen in verdampingsapparatuur te verwijderen..
Sulfaminezuur is een nitrietreductiemiddel (NOtwee-) en deze chemische eigenschap wordt gebruikt in verschillende toepassingen, zoals in de kleurstofindustrie en bij nitrietanalyse..
Het wordt gebruikt bij het looien van leer en het bleken van pulp voor het maken van papier. Het is zelfs een voedselverontreinigende stof, omdat het vaak wordt aangetroffen in het papier en karton dat wordt gebruikt om boodschappen in te pakken..
Het wordt ook gebruikt bij de elektrodepositie van metalen, als laboratoriumstandaard en een van de derivaten ervan is een zeer effectief herbicide..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Dichtheid
- 3.5 Oplosbaarheid
- 3,6 pH
- 3.7 Dissociatieconstante
- 3.8 Chemische eigenschappen
- 3.9 Overige eigenschappen
- 4 Synthese
- 5 toepassingen
- 5.1 In de kleurstofindustrie
- 5.2 Bij leerverwerking
- 5.3 Bij het reinigen van procesapparatuur
- 5.4 Bij metaalraffinage
- 5.5 Als standaardreagens in het laboratorium
- 5.6 Bij nitrietanalyse
- 5.7 Bij de analyse van opgeloste zuurstof in water
- 5.8 Bij de bereiding van lachgas
- 5.9 In de landbouw
- 5.10 Op vuurvaste stoffen
- 5.11 In verschillende toepassingen
- 6 referenties
Structuur
Sulfaminezuur kristalliseert in de vorm van dipyramidale orthorhombische kristallen. Vormt compacte prisma's en platen bij kristallisatie uit koude oplossing, evenals diamantplaten bij kristallisatie uit hete waterige oplossing.
Nomenclatuur
- Sulfaminezuur
- Aminosulfonzuur
- Amidosulfonzuur
- Amidosulfuric zuur
- Sulfamidezuur
Eigendommen
Fysieke toestand
Witte kristallijne vaste stof.
Molecuulgewicht
97,1 g / mol.
Smeltpunt
205 ºC, ontleedt bij 209 ºC.
Dichtheid
2,15 g / cm3
Oplosbaarheid
Oplosbaar in water:
- 12,8% bij 0 ºC
- 17,57% bij 20 ºC
- 22,77% bij 40 ºC
Lichtjes oplosbaar in methanol, lichtjes oplosbaar in aceton, onoplosbaar in ether.
Gemakkelijk oplosbaar in stikstofhoudende basen en in organische oplosmiddelen die stikstof bevatten.
Onoplosbaar in koolstofdisulfide (CStwee) en tetrachloorkoolstof (CCl4.
pH
0,41 (in 1 N-oplossing, dat wil zeggen 1 equivalent / L).
Dissociatieconstante
0,101 bij 25 ºC.
Chemische eigenschappen
Het is een sterk zuur. Bijna evenveel als zoutzuur (HCl), salpeterzuur (HNO3) en zwavelzuur (H.tweeSW4.
Waterige oplossingen van sulfaminezuur zijn sterk geïoniseerd. De pH is lager dan de oplossingen van mierenzuur, fosforzuur en oxaalzuur.
In water verliest sulfaminezuur alleen het proton dat aan zuurstof is gebonden. Waterstofatomen gebonden aan stikstof houden stevig bij elkaar.
In waterige oplossing hydrolyseert het langzaam om zuur ammoniumsulfaat (NH4HSO4Het is stabiel in droge omstandigheden.
Sulfaminezuur valt metalen, metaaloxiden en carbonaten aan om sulfamaten te genereren. Met het metaal kalium (K) vormt het bijvoorbeeld kaliumsulfamaat (KOSOtweeNHtwee) en waterstof (H.twee.
Alle zouten van sulfaminezuur zijn oplosbaar in water. De zouten van calcium, lood en barium zijn zeer goed oplosbaar in water, in tegenstelling tot de overeenkomstige zouten van zwavelzuur.
Salpeterig zuur (HNOtwee) reageert kwantitatief met de aminogroep van sulfaminezuur, waarbij stikstof (N.tweeGeschat wordt dat het sulfamaat-ion in deze reactie functioneert als een amide, niet als een amine..
Sulfaminezuur wordt geoxideerd door chloor, broom of kaliumchloraat om het om te zetten in zwavelzuur. Deze reactie vindt niet plaats met andere oxidatiemiddelen zoals chroomzuur of kaliumpermanganaat..
Het is niet compatibel (reageert) met sterke basen, chloor, hypochloorzuur, hypochlorieten, cyaniden en sulfiden.
Andere eigenschappen
Het is niet hygroscopisch (dit betekent dat het geen vocht uit de lucht opneemt).
Bij verhitting tot ontbinding geeft het zeer giftige dampen af van zwaveloxiden en waterstofchloride (HCl).
Een van zijn derivaten, ammoniumsulfamaat, is brandvertragend.
Het is matig giftig.
Synthese
Sulfaminezuur wordt verkregen door ureum CO (NHtweetwee met rokend zwavelzuur, dat wil zeggen zwavelzuur (H.tweeSW4) concentraat met zwaveltrioxide (SO3.
Het kan ook worden gesynthetiseerd door chloorsulfonzuur (HClO3Cl) en ammoniak (NH3.
Toepassingen
In de kleurstofindustrie
Sulfaminezuur wordt gebruikt om overtollige nitrieten snel en effectief te verwijderen bij diazoteringsreacties bij de synthese van kleurstoffen. Het is voor dit doel veel praktischer dan ureum.
In leerverwerking
Bij het looien van leer zorgt het gebruik van sulfaminezuur in plaats van zwavelzuur voor een fijnere en zijdezachte textuur.
Bovendien, aangezien calciumsulfamaat oplosbaar is in water, in tegenstelling tot calciumsulfaat, kan sulfaminezuur worden gebruikt in het ontkalkingsproces zonder de vlekken achter te laten die soms op leer voorkomen bij gebruik van zwavelzuur..

Bij het reinigen van procesapparatuur
Sulfaminezuur wordt gebruikt als ontkalkingsreiniger in ketels, reactoren, leidingen, koelsystemen en warmtewisselaars.
In deze apparatuur worden afzettingen gevormd door de circulatie van water of procesverbindingen in energiecentrales, chemische fabrieken, staalfabrieken, papierfabrieken, compressiestations en andere industrieën..
Kalkaanslag of vaste afzettingen kunnen organisch zijn (algen, slib, schimmels) of anorganisch (ijzeroxiden, ijzersulfiden, calcium- of magnesiumcarbonaten, sulfaten, fosfaten of silicaten).
Sulfaminezuur is zeer effectief wanneer het wordt gebruikt om calciumcarbonaataanslag te verwijderen. Kan worden gebruikt op koper, messing, roestvrij staal, gietijzer en gegalvaniseerd stalen apparatuur.
Het wordt gebruikt in de vorm van een 5-10 gew.% Oplossing. Het wordt vooral gebruikt in suikermolens om verdampers van gietijzer met koperen warmtewisselaars te reinigen.

Het mag worden gebruikt bij temperaturen niet hoger dan 50-60 ºC. Temperaturen van 70 ºC leiden tot de vorming van onoplosbare sulfaten zoals CaSO4.
Bij gebruik in combinatie met natriumchloride treedt een synergetisch effect op en laat de oplossing het ijzeroxide langzaam oplossen. In dit geval mag het niet worden gebruikt met roestvrij staal omdat er zoutzuur vrijkomt dat corrosie in dit materiaal kan veroorzaken..
Bij het raffineren van metaal
Het galvaniseren van metalen zoals koper, zilver, kobalt, nikkel, zink, cadmium, ijzer en lood kan met succes worden uitgevoerd in sulfaminezuuroplossingen. Dit kan veel gemakkelijker worden gehanteerd dan fluorwaterstofzuur (H.tweeSiF6.
Als standaardreagens in het laboratorium
Gezien bepaalde kenmerken van sulfaminezuur, zoals: zijn sterkte als zuur, zijn gemakkelijke zuivering door herkristallisatie in water, zijn stabiliteit en zijn niet-hygroscopiciteit, is het op laboratoriumniveau als primaire standaard gebruikt. Dit betekent dat het wordt gebruikt voor kwantitatieve alkalibepalingen..

Bij nitrietanalyse
Vanwege de gemakkelijke reactie met nitrieten, wordt sulfaminezuur gebruikt om deze in oplossing te bepalen..
Bij de analyse van opgeloste zuurstof in water
Omdat sulfaminezuur reageert met de nitrieten in het water, komt stikstof vrij, het is mogelijk om de bepaling van opgeloste zuurstof in water uit te voeren, omdat de interferentie veroorzaakt door nitrieten wordt geëlimineerd..
Bij de bereiding van lachgas
Sulfaminezuur reageert met salpeterzuur om lachgas (N.tweeOF). Deze reactie is veiliger dan die van ammoniumnitraat om dit gas te verkrijgen.
In de landbouw
Een derivaat van sulfaminezuur, ammoniumsulfamaat, is een effectief niet-toxisch herbicide voor dieren.
Het wordt met dauw aangebracht op de bladeren van de te verwijderen soort aan het einde van de zomer of vroege herfst, bij voorkeur bij vochtig weer. Terwijl de verbinding van de bladeren naar de wortels reist, sterft de plant.

Een ander voordeel van deze verbinding is dat het de grond niet permanent steriliseert. Inderdaad, een deel van de stikstof uit ammoniumsulfamaat zal het komende seizoen in de bodem beschikbaar zijn voor plantengroei..
In vuurvaste stoffen
De compatibiliteit met cellulose en de brandvertragende eigenschappen maken ammoniumsulfamaat tot een middel voor het verkrijgen van brandwerende weefsels en papier..
Het wordt gebruikt voor 10% van het gewicht van de stof, waarvan het uiterlijk en het gevoel bij aanraking ongewijzigd blijven. De stof moet tijdens gebruik chemisch worden gereinigd, nooit met water worden gewassen om het sulfamaat niet op te lossen.
Het is vooral handig in theatergordijnen of soortgelijke plaatsen.

In verschillende toepassingen
Het wordt gebruikt als katalysator bij sommige chemische reacties, zoals bij de bereiding van ureum-formaldehydeharsen. Het is ook nuttig als bactericide en chloorstabilisator in zwembaden en als bleekmiddel voor houtpulp in pulp- en papierfabrieken..
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Sulfaminezuur. Opgehaald van pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrosering in stikstofcentra. In nitrosatiereacties en de chemie van stikstofoxide. Hoofdstuk 2. Hersteld van sciencedirect.com
- Clapp, Leallyn B. (1943). Sulfaminezuur en zijn toepassingen. Chem. Educ. 1943, 20, 4, 189. Opgehaald van pubs.acs.org
- McDonald, James. (2003). Sulfaminezuur. Opgehaald van veoliawatertech.com
- Sastri, V.S. (2010). Beheer en beheersing van corrosie. In de corrosie van Shreir. Opgehaald van sciencedirect.com
- Pratima Bajpai. (2018). Diverse onderwerpen. In Biermann's Handbook of Pulp and Paper. Derde editie. Opgehaald van sciencedirect.com



Niemand heeft nog op dit artikel gereageerd.