
Ethylethereigenschappen, structuur, productie, gebruik
De ethylether, ook bekend als diethylether, het is een organische verbinding waarvan de chemische formule C is4H.10O. Het wordt gekenmerkt door een kleurloze en vluchtige vloeistof en daarom moeten de flessen zo goed mogelijk gesloten worden gehouden.
Deze ether is geclassificeerd als een lid van de dialkylethers; dat wil zeggen, ze hebben de formule ROR ', waarbij R en R' verschillende koolstofsegmenten voorstellen. En zoals beschreven door de tweede naam, diethylether, zijn het twee -ethylradicalen die zich binden aan het zuurstofatoom.

Ethylether werd aanvankelijk gebruikt als een algemeen verdovingsmiddel, geïntroduceerd in 1846 door William Thomas Green Morton. Vanwege zijn ontvlambaarheid werd het gebruik ervan echter weggegooid en vervangen door andere, minder gevaarlijke anesthetica..
Deze verbinding is ook gebruikt om de tijd van bloedcirculatie te schatten tijdens de evaluatie van de cardiovasculaire status van patiënten..
In het lichaam kan diethylether worden omgezet in kooldioxide en metabolieten; de laatste worden in de urine uitgescheiden. De meeste toegediende ether wordt echter zonder enige wijziging in de longen uitgeademd..
Aan de andere kant wordt het gebruikt als oplosmiddel voor zepen, oliën, parfums, alkaloïden en tandvlees..
Artikel index
- 1 Structuur van ethylether
- 1.1 Intermoleculaire krachten
- 2 Fysische en chemische eigenschappen
- 2.1 Andere namen
- 2.2 Moleculaire formule
- 2.3 Molecuulgewicht
- 2.4 Fysiek voorkomen
- 2.5 Geur
- 2.6 Smaak
- 2.7 Kookpunt
- 2.8 Smeltpunt
- 2.9 Vlampunt
- 2.10 Oplosbaarheid in water
- 2.11 Oplosbaarheid in andere vloeistoffen
- 2.12 Dichtheid
- 2.13 Dampdichtheid
- 2.14 Dampspanning
- 2.15 Stabiliteit
- 2.16 Automatische ontsteking
- 2.17 Ontleding
- 2.18 Viscositeit
- 2.19 Verbrandingswarmte
- 2.20 Verdampingswarmte
- 2.21 Oppervlaktespanning
- 2.22 Ionisatiepotentieel
- 2.23 Geurdrempelwaarde
- 2.24 Brekingsindex
- 3 Verkrijgen
- 3.1 Van ethylalcohol
- 3.2 Van ethyleen
- 4 Toxiciteit
- 5 toepassingen
- 5.1 Organisch oplosmiddel
- 5.2 Algemene anesthesie
- 5.3 Spirit of Ether
- 5.4 Beoordeling van de bloedcirculatie
- 5.5 Onderwijslaboratoria
- 6 referenties
Structuur van ethylether
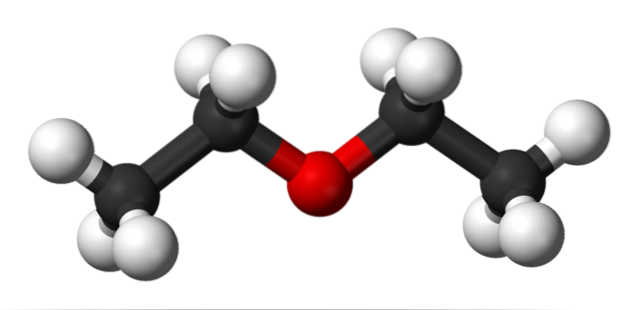
In de bovenste afbeelding is er een weergave met een model van bollen en staven van de moleculaire structuur van ethylether..
Zoals te zien is, heeft de rode bol, die overeenkomt met het zuurstofatoom, twee ethylgroepen die aan beide zijden zijn verbonden. Alle schakels zijn eenvoudig, flexibel en draaien vrij rond de σ-assen.
Deze rotaties geven aanleiding tot stereo-isomeren die bekend staan als conformeren; dat het meer dan isomeren zijn, maar alternatieve ruimtelijke toestanden. De structuur van het beeld komt exact overeen met de anticonformer, waarin al zijn groepen atomen versprongen zijn (van elkaar gescheiden).
Wat zou de andere conformer zijn? De verduisterde, en hoewel het beeld ervan niet beschikbaar is, volstaat het om het in een U-vorm te visualiseren. Aan de bovenkant van de U bevinden zich de methylgroepen, -CH3, die sterische afstotingen zouden ervaren (botsen in de ruimte).
Daarom wordt verwacht dat het CH-molecuul3CHtweeOCHtweeCH3 gebruik meestal anti-shaping.
Intermoleculaire krachten
Door welke intermoleculaire krachten worden de ethylethermoleculen in de vloeibare fase beheerst? Ze worden voornamelijk in de vloeistof gehouden dankzij de dispersiekrachten, aangezien hun dipoolmoment (1.5D) een voldoende gebrekkig gebied in elektronendichtheid (δ +) mist
Dit komt omdat geen enkel koolstofatoom in de ethylgroepen te veel elektronendichtheid afgeeft aan het zuurstofatoom. Het bovenstaande is duidelijk met de elektrostatische potentiaalkaart van ethylether bij de hand (onderste afbeelding). Let op de afwezigheid van een blauw gebied.
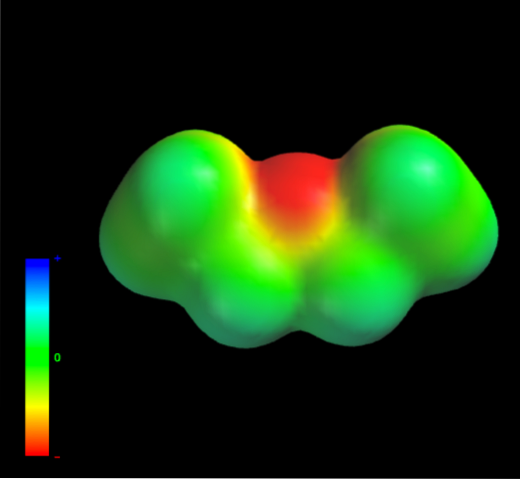
Zuurstof kan ook geen waterstofbruggen vormen, want er zijn geen O-H-bindingen in de moleculaire structuur. Daarom zijn het de momentane dipolen en hun moleculaire massa die hun verspreidingskrachten bevorderen..
Desondanks is het zeer goed oplosbaar in water. Waarom? Omdat zijn zuurstofatoom, met een hogere elektronendichtheid, waterstofbruggen van een watermolecuul kan accepteren:
(CH3CHtweetweeOFδ- - δ+H-OH
Deze interacties zijn verantwoordelijk voor 6,04 g van deze ether die oplost in 100 ml water.
Fysische en chemische eigenschappen
Andere namen
-Diethyl ether
-Ethoxyethaan
-Ethyl oxide
Moleculaire formule
C4H.10O of (CtweeH.5tweeOF.
Molecuulgewicht
74,14 g / mol.
Fysiek uiterlijk
Kleurloze vloeistof.
Geur
Zoet en pittig.
Smaak
Brandend en zoet.
Kookpunt
94,3 ºF (34,6 ºC) bij 760 mmHg.
Smeltpunt
-177,3 ° F (-116,3 ° C). Stabiele kristallen.
ontstekingspunt
-49ºF (gesloten container).
Oplosbaarheid in water
6,04 g / 100 ml bij 25 ºC.
Oplosbaarheid in andere vloeistoffen
Mengbaar met alifatische alcoholen met een korte keten, benzeen, chloroform, petroleumether, vetoplosmiddel, veel oliën en geconcentreerd zoutzuur.
Oplosbaar in aceton en zeer goed oplosbaar in ethanol. Het is ook oplosbaar in nafta, benzeen en oliën.
Dichtheid
0,714 mg / ml bij 68 ªF (20 ºC).
Dampdichtheid
2,55 (in verhouding tot lucht genomen met dichtheid 1).
Dampdruk
442 mmHg bij 68ºF. 538 mmHg bij 25 ° C. 58,6 kPa bij 20 ºC.
Stabiliteit
Het wordt langzaam geoxideerd door de inwerking van lucht, vocht en licht onder vorming van peroxiden.
De vorming van peroxiden kan optreden in ethercontainers die geopend zijn en die langer dan zes maanden bewaard blijven. Peroxiden kunnen tot ontploffing worden gebracht door wrijving, stoten of verhitting.
Vermijd contact met: zink, halogenen, niet-metaalhoudende oxyhalogeniden, sterke oxidatiemiddelen, chromylchloride, tementine-oliën, metaalnitraten en -chloriden.
Automatische ontsteking
356 ºF (180 ºC).
Ontleding
Bij verhitting ontleedt het en geeft bijtende en irriterende rook af.
Viscositeit
0.2448 cPoise bij 20 ºC.
Verbrandingswarmte
8,807 Kcal / g.
Warmte van verdamping
89,8 cal / g bij 30 ºC.
Oppervlaktespanning
17,06 dynes / cm bij 20 ° C.
Ionisatiepotentieel
9,53 eV.
Geurdrempel
0,83 ppm (zuiverheid wordt niet gegeven).
Brekingsindex
1.355 bij 15 ºC.
Het verkrijgen van
Van ethylalcohol
Ethylether kan worden verkregen uit ethylalcohol, in aanwezigheid van zwavelzuur als katalysator. Zwavelzuur in een waterig medium dissocieert en produceert het hydroniumion, H3OF+.
De watervrije ethylalcohol stroomt door de zwavelzuuroplossing, verwarmd tussen 130 ° C en 140 ° C, en produceert de protonering van ethylalcoholmoleculen. Vervolgens reageert een ander niet-geprotoneerd ethylalcoholmolecuul met het geprotoneerde molecuul.
Wanneer dit gebeurt, bevordert de nucleofiele aanval van het tweede ethylalcoholmolecuul de afgifte van water uit het eerste molecuul (het geprotoneerde molecuul); als resultaat, een geprotoneerde ethylether (CH3CHtweeOHCHtweeCH3), met gedeeltelijk positief geladen zuurstof.
Deze synthesemethode verliest echter aan efficiëntie omdat het zwavelzuur geleidelijk wordt verdund met het water dat tijdens het proces wordt geproduceerd (product van de dehydratatie van ethylalcohol)..
De reactietemperatuur is kritisch. Bij temperaturen onder 130ºC is de reactie traag en wordt ethylalcohol grotendeels gedestilleerd..
Boven 150 ºC veroorzaakt zwavelzuur de vorming van ethyleen (het alkeen met dubbele binding), in plaats van te combineren met ethylalcohol om ethylether te vormen.
Van ethyleen
In het omgekeerde proces, dat wil zeggen de hydratatie van ethyleen in de dampfase, kan naast ethylalcohol ethylether als bijproduct worden gevormd. In feite produceert deze synthetische route het grootste deel van deze organische verbinding..
Bij dit proces worden fosforzuurkatalysatoren gebruikt die zijn bevestigd aan een vaste drager, die kan worden aangepast om meer ether te produceren..
Dehydratatie van ethanol in de dampfase in aanwezigheid van aluminiumoxidekatalysatoren kan een opbrengst van 95% geven bij de productie van ethylether..
Toxiciteit
Kan bij contact huid- en oogirritatie veroorzaken. Contact met de huid kan uitdroging en barsten veroorzaken. Ether dringt meestal niet door de huid, omdat het snel wordt verdampt.
Oogirritatie veroorzaakt door ether is meestal mild en in het geval van ernstige irritatie is de schade over het algemeen omkeerbaar.
De inname veroorzaakt verdovende effecten en maagirritatie. Ernstige inname kan nierbeschadiging veroorzaken.
Inademing van ether kan irritatie van de neus en keel veroorzaken. Bij inademing van ether kan het volgende optreden: slaperigheid, opwinding, duizeligheid, braken, onregelmatige ademhaling en verhoogde speekselvloed..
Hoge blootstelling kan bewusteloosheid en zelfs de dood tot gevolg hebben.
OSHA stelt een beroepsmatige blootstellingslimiet in de lucht van 800 ppm vast, gemiddeld over een 8-uurploeg..
Oogirritatieniveaus: 100 ppm (mens). Oogirritatieniveaus: 1200 mg / m23 (400 pagina's per minuut).
Toepassingen
Organisch oplosmiddel
Het is een organisch oplosmiddel dat wordt gebruikt om broom, jodium en andere halogenen op te lossen; meeste lipiden (vetten), harsen, pure rubbers, sommige alkaloïden, gommen, parfums, celluloseacetaat, cellulosenitraat, koolwaterstoffen en kleurstoffen.
Bovendien wordt het gebruikt bij de extractie van actieve bestanddelen uit dierlijke en plantaardige weefsels, omdat het een lagere dichtheid heeft dan water en erop drijft, waardoor de gewenste stoffen in de ether worden opgelost..
Narcose
Het wordt sinds 1840 gebruikt als algemeen anestheticum en vervangt chloroform omdat het een therapeutisch voordeel heeft. Het is echter een ontvlambare stof en ondervindt daarom ernstige problemen bij het gebruik ervan in klinische omgevingen..
Bovendien veroorzaakt het enkele ongewenste postoperatieve bijwerkingen zoals misselijkheid en braken bij patiënten..
Om deze redenen is het gebruik van ether als algemeen anestheticum weggegooid en vervangen door andere anesthetica zoals halothaan..
Ether Geest
Ether gemengd met ethanol werd gebruikt om de oplossing te vormen die etherische ether wordt genoemd, die wordt gebruikt bij de behandeling van maagwinderigheid en mildere vormen van gastralgie..
Evaluatie van de bloedcirculatie
Ether is gebruikt om de bloedcirculatie tussen een arm en de longen te evalueren. Ether wordt in een arm geïnjecteerd en brengt het bloed naar het rechteratrium, vervolgens naar het rechterventrikel en van daaruit naar de longen..
De tijd die verstrijkt vanaf de injectie van de ether, tot het vangen van de geur van de ether in de uitgeademde lucht, is ongeveer 4 tot 6 s.
Onderwijslaboratoria
Ether wordt in veel experimenten gebruikt in onderwijslaboratoria; bijvoorbeeld bij de demonstratie van Mendels wetten van de genetica.
Ether wordt gebruikt om de vliegen van het geslacht Drosophila te laten sussen en de nodige kruisingen tussen hen mogelijk te maken, waardoor de wetten van de genetica worden bewezen
Referenties
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10th editie.). Wiley plus.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- De Sevier. (2018). Diethyl ether. Science Direct. Hersteld van: sciencedirect.com
- De redactie van Encyclopaedia Britannica. (2018). Ethylether. ncyclopædia Britannica. Hersteld van: britannica.com
- PubChem (2018). Ether. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Diethyl ether. Hersteld van: en.wikipedia.org
- Veiligheidsblad XI: ethylether. [Pdf]. Hersteld van: quimica.unam.mx



Niemand heeft nog op dit artikel gereageerd.