
Structuur, eigenschappen, risico's en toepassingen van jodiumzuur (HIO3)

De jodiumzuur is een anorganische verbinding met formule HIO3. Het is een oxacidzuur van jodium, dat in dit molecuul een oxidatietoestand van +5 heeft. Deze verbinding is een zeer sterk zuur en wordt vaak gebruikt om oplossingen van zwakke en sterke basen te standaardiseren om ze voor te bereiden op titraties..
Het wordt gevormd door diatomisch jodium te oxideren met salpeterzuur, chloor, waterstofperoxide of zoutzuur, zoals blijkt uit de volgende reactie: Itwee + 6HtweeO + 5Cltwee ⇌ 2HIO3 + 10HCl.
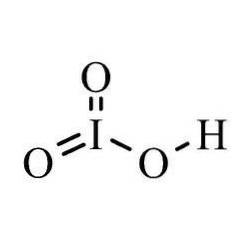
Bij elke reactie verliest diatomisch jodium elektronen en vormt het een complex met waterstof en zuurstof. Vanwege zijn ionische en oplosbare eigenschappen is ionisch zuur ook een zeer sterk zuur..
Artikel index
- 1 Fysische en chemische eigenschappen van jodiumzuur
- 2 Reactiviteit en gevaren
- 3 Gebruik en gezondheidsvoordelen
- 4 referenties
Fysische en chemische eigenschappen van jodiumzuur
Jodiumzuur is een witte vaste stof bij kamertemperatuur (Royal Society of Chemistry, 2015).

Joodzuur heeft een molecuulgewicht van 175,91 g / mol en een dichtheid van 4,62 g / ml. Het is zeer oplosbaar in water en kan 269 gram zuur per 100 ml oplossen. Het smeltpunt is 110 graden Celsius, waar het begint te ontleden door uitdroging tot jodiumpentoxide.
Met daaropvolgende verwarming van de verbinding tot een hogere temperatuur, ontleedt het om een mengsel van jodium, zuurstof en lagere jodiumoxiden te geven (National Center for Biotechnology Information, S.F.).
Het is een relatief sterk zuur met een zuurgraad van 0,75. Het jodium- of jodide-ion is het product van deze verbinding wanneer het wordt geoxideerd. Bij een zeer lage pH en hoge chloride-ionenconcentratie wordt het gereduceerd tot jodiumtrichloride, een gele verbinding in oplossing.
Reactiviteit en gevaren
Jodiumzuur is een stabiele verbinding onder normale omstandigheden. Omdat het een sterk zuur is, is het buitengewoon gevaarlijk in geval van contact met de huid (bijtend en irriterend), contact met de ogen (irriterend) en bij inslikken. Bovendien is het ook erg gevaarlijk in geval van inademing (IODIC ACID, S.F.).
De hoeveelheid weefselschade hangt af van de lengte van het contact. Contact met de ogen kan leiden tot beschadiging van het hoornvlies of blindheid. Contact met de huid kan ontstekingen en blaren veroorzaken. Het inademen van stof veroorzaakt irritatie van het maagdarmkanaal of de luchtwegen, gekenmerkt door verbranding, niezen en hoesten..
Ernstige overmatige blootstelling kan longschade, verstikking, bewustzijnsverlies of de dood veroorzaken. Langdurige blootstelling kan brandwonden en zweren op de huid veroorzaken. Overmatige blootstelling door inademing kan irritatie van de luchtwegen veroorzaken..
Ontsteking van het oog wordt gekenmerkt door roodheid, tranen en jeuk. Ontsteking van de huid wordt gekenmerkt door jeuk, schilfering, roodheid of soms blaarvorming.
De stof is giftig voor de nieren, longen en slijmvliezen.
Herhaalde of langdurige blootstelling aan de stof kan schade aan deze organen en irritatie van de ogen veroorzaken. Periodieke blootstelling van de huid kan plaatselijke vernietiging van de huid of dermatitis veroorzaken..
Herhaaldelijk inademen van stof kan in verschillende mate irritatie van de luchtwegen of longschade veroorzaken. Langdurige inademing van stof kan chronische irritatie van de luchtwegen veroorzaken..
Controleer in geval van contact met de ogen of u contactlenzen draagt en verwijder deze onmiddellijk. De ogen moeten gedurende minstens 15 minuten met stromend water worden gespoeld, waarbij de oogleden open moeten blijven en koud water moet kunnen worden gebruikt. Oogzalf mag niet worden gebruikt.
Als de chemische stof in contact komt met kleding, moet u deze zo snel mogelijk verwijderen en daarbij uw eigen handen en lichaam beschermen. Plaats het slachtoffer onder een veiligheidsdouche.
Als de chemische stof zich ophoopt op de blootgestelde huid van het slachtoffer, zoals op de handen, wordt de besmette huid voorzichtig en voorzichtig gewassen met stromend water en niet-schurende zeep. Als irritatie aanhoudt, medische hulp inroepen en verontreinigde kleding wassen alvorens deze opnieuw te gebruiken..
Als het contact met de huid ernstig is, moet deze worden gewassen met een desinfecterende zeep en de besmette huid bedekken met een antibacteriële crème..
Bij inademing moet het slachtoffer rusten in een goed geventileerde ruimte. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilige plaats worden geëvacueerd en moet strakke kleding (overhemdkraag, riem of das) worden losgemaakt..
Als het slachtoffer moeite heeft met ademen, moet zuurstof worden toegediend. In het extreme geval van niet ademen, wordt mond-op-mondbeademing uitgevoerd. Er moet natuurlijk rekening mee worden gehouden dat het gevaarlijk kan zijn voor degene die hulp verleent als het ingeademde materiaal giftig, besmettelijk of bijtend is..
Bij inslikken geen braken opwekken, kleding losmaken en, als het slachtoffer niet ademt, mond-op-mondbeademing uitvoeren.
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (Material Safety Data Sheet Iodic acid, 2013).
Gebruik en gezondheidsvoordelen
Jodiumzuur wordt vaak gebruikt als standaardiseringsmiddel voor oplossingen van zwakke en sterke basen. Het is een sterk zuur dat in de analytische chemie wordt gebruikt om titraties uit te voeren.
Wordt gebruikt met methylrode of methyloranje-indicatoren om equivalentiepuntmetingen bij titraties uit te voeren.
Het wordt in de zoutindustrie gebruikt om natrium- of kaliumjodaatzout te synthetiseren. Door deze jodiumzuurverbinding te gebruiken bij de bereiding van het zout, wordt het jodiumgehalte van het zout verhoogd (Omkar Chemicals, 2016).
Deze verbinding wordt al lang gebruikt voor organische synthese omdat het het vermogen heeft om selectief organische verbindingen te oxideren, gezien zijn werking om gelijkwaardige partiële oxidatieanalyses uit te voeren, een nuttige techniek om structuren te bepalen (Roger J. Williams, 1937).
Jodium en joodzuur worden gebruikt als een efficiënte combinatie van reagentia voor de jodering van arylhydroxyketonen. In het werk van (Bhagwan R. Patila, 2005) werd een verscheidenheid aan ortho-hydroxy gesubstitueerde aromatische carbonylverbindingen regioselectief gejodeerd met jodium en jodiumzuur met uitstekende opbrengsten..
Referenties
- Bhagwan R. Patila, S. R. (2005). Jodium en joodzuur: een efficiënte reagenscombinatie voor jodering van arylhydroxyketonen. Tetrahedron Letters Volume 46, Issue 42, 7179-7181. arkat-usa.org.
- JODENZUUR. (S.F.). Opgehaald van chemicalland21: chemicalland21.com.
- Veiligheidsinformatieblad Jodiumzuur. (2013, 21 mei). Opgehaald van sciencelab: sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie. (S.F.). PubChem samengestelde database; CID = 24345. Opgehaald van PubChem.
- Omkar Chemicals. (2016, 11 juni). AARD VAN JODENZUUR EN HET GEBRUIK IN VERSCHILLENDE DOELEINDEN. Opgehaald van de officiële blog van Omkar Chemicals: omkarchemicals.com.
- Roger J. Williams, M. A. (1937). DE SELECTIVITEIT VAN JODENZUUR BIJ DE OXIDATIE VAN ORGANISCHE VERBINDINGEN. journal of american chemical society 59 (7), 1408-1409.
- Royal Society of Chemistry. (2015). Jodiumzuur. Opgehaald van chemspider: chemspider.com.


Niemand heeft nog op dit artikel gereageerd.