
Hydrojoodzuur (HI) structuur, eigenschappen en toepassingen

De joodwaterstofzuur Het is een waterige oplossing van waterstofjodide die wordt gekenmerkt door zijn hoge zuurgraad. Een definitie die dichter bij de chemische en IUPAC-terminologie ligt, is dat het een hydracide is, waarvan de chemische formule HI is.
Om het echter te onderscheiden van gasvormige waterstofjodidemoleculen, wordt HI (g) aangeduid als HI (aq). Om deze reden is het in chemische vergelijkingen belangrijk om de medium- of fysische fase te identificeren waarin de reactanten en producten worden aangetroffen. Toch is er vaak verwarring tussen waterstofjodide en joodwaterstofzuur..
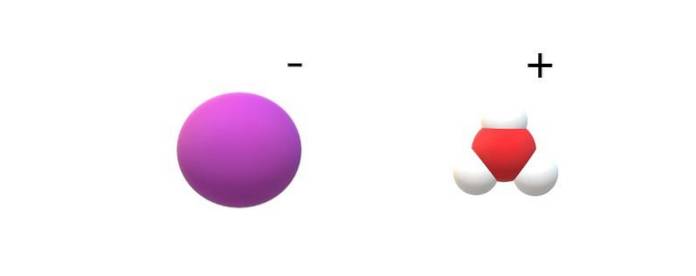
Als de moleculen die in hun identiteit zijn vastgelegd, worden waargenomen, zullen merkbare verschillen worden gevonden tussen HI (g) en HI (ac). In HI (g) is er een H-I-binding; terwijl ze in HI (ac) eigenlijk een ionenpaar I zijn- en H3OF+ elektrostatisch wisselend (bovenste afbeelding).
Aan de andere kant is HI (ac) een bron van HI (g), aangezien de eerste wordt bereid door de tweede op te lossen in water. Daarom kan HI ook worden gebruikt om naar joodwaterstofzuur te verwijzen, tenzij het in een chemische vergelijking staat. HI is een sterk reductiemiddel en een uitstekende bron van I-ionen.- in waterig medium.
Artikel index
- 1 Structuur van joodwaterstofzuur
- 2 Eigenschappen
- 2.1 Fysieke beschrijving
- 2.2 Molecuulmassa
- 2.3 Geur
- 2.4 Dichtheid
- 2.5 Kookpunt
- 2,6 pKa
- 2.7 Zuurgraad
- 2.8 Reductiemiddel
- 3 Nomenclatuur
- 4 toepassingen
- 4.1 Bron van jodium in organische en anorganische syntheses
- 4.2 Reductiemiddel
- 4.3 Cativa-proces
- 4.4 Illegale syntheses
- 5 referenties
Structuur van joodwaterstofzuur
Zoals zojuist uitgelegd, bestaat joodwaterstofzuur uit een oplossing van HI in water. Omdat ze zich in water bevinden, dissociëren de HI-moleculen volledig (sterke elektrolyt), waarbij ze de I-ionen voortbrengen- en H3OF+. Deze dissociatie kan worden weergegeven door de volgende chemische vergelijking:
HI (g) + HtweeO (l) => ik-(ac) + H3OF+(ac)
Wat zou equivalent zijn als het zou zijn geschreven als:
HI (g) + HtweeO (l) => HI (ac)
HI (ac) onthult echter helemaal niet wat er met de gasvormige HI-moleculen is gebeurd; het geeft alleen aan dat ze zich in een waterig medium bevinden.
Daarom bestaat de werkelijke structuur van HI (ac) uit de ionen I- en H3OF+ omgeven door watermoleculen die ze hydrateren; hoe geconcentreerder het joodwaterstofzuur, hoe lager het aantal niet-geprotoneerde watermoleculen.
Commercieel is de HI-concentratie in feite 48 tot 57% in water; meer geconcentreerd zou gelijk staan aan te rokend zuur (en zelfs gevaarlijker).
In de afbeelding is te zien dat het anion I- wordt weergegeven door een paarse bol, en H3OF+ met witte bollen en een rode, voor het zuurstofatoom. Het kation H3OF+ kenmerkt trigonale piramide moleculaire geometrie (gezien vanuit een hoger vlak in de afbeelding).
Eigendommen
Fysieke beschrijving
Kleurloze vloeistof; maar het kan gelige en bruine tinten vertonen als het in direct contact met zuurstof staat. Dit komt doordat de ionen I- uiteindelijk oxideren tot moleculair jodium, I.twee. Als er veel is, heb iktwee, het is meer dan waarschijnlijk dat het trijodide-anion wordt gevormd, I3-, waardoor de oplossing bruin wordt.
Moleculaire massa
127,91 g / mol.
Geur
Acre.
Dichtheid
De dichtheid is 1,70 g / ml voor de 57% HI-oplossing; aangezien de dichtheden variëren afhankelijk van de verschillende concentraties HI. Bij deze concentratie wordt een azeotroop gevormd (het wordt gedestilleerd als een enkele stof en niet als een mengsel), waardoor het relatief stabiel kan zijn vanwege de commercialisering ervan ten opzichte van andere oplossingen..
Kookpunt
De 57% HI-azeotroop kookt bij 127 ° C bij een druk van 1,03 bar (GO TO ATM).
pKa
-1,78.
Zuurgraad
Het is een extreem sterk zuur, zo erg zelfs dat het bijtend is voor alle metalen en weefsels; zelfs voor rubbers.
Dit komt doordat de H-I-binding erg zwak is en gemakkelijk breekt tijdens ionisatie in water. Bovendien waterstofbruggen I- - HOHtwee+ zijn zwak, dus er is niets dat de H verstoort3OF+ reageren met andere verbindingen; dat wil zeggen, de H3OF+ is "vrij" geweest, zoals de ik- dat trekt niet al te veel kracht naar zijn tegenion.
Reductiemiddel
HI is een krachtig reductiemiddel, waarvan het belangrijkste reactieproduct I istwee.
Nomenclatuur
De nomenclatuur voor joodwaterstofzuur is afgeleid van het feit dat jodium "werkt" met een enkele oxidatietoestand: -1. En ook, dezelfde naam geeft aan dat er water in zijn structuurformule zit [I-] [H3OF+Dit is de enige naam, want het is geen pure verbinding maar een oplossing.
Toepassingen
Bron van jodium in organische en anorganische syntheses
HI is een uitstekende bron van ionen I.- voor anorganische en organische syntheses, en is ook een krachtig reductiemiddel. De 57% waterige oplossing wordt bijvoorbeeld gebruikt voor de synthese van alkyljodiden (zoals CH3CHtweeI) van primaire alcoholen. Evenzo kan een OH-groep worden vervangen door een I in een structuur.
Reductiemiddel
Joodwaterstofzuur is gebruikt om bijvoorbeeld koolhydraten te verminderen. Als glucose opgelost in dit zuur wordt verwarmd, verliest het al zijn OH-groepen en verkrijgt het de koolwaterstof n-hexaan als een product..
Evenzo is het gebruikt om de functionele groepen van grafeenvellen zodanig te verkleinen dat ze kunnen worden gefunctionaliseerd voor elektronische apparaten..
Cativa-proces

Stappen
Het proces begint (1) met het organo-iridiumcomplex [Ir (CO)tweeiktwee-, vierkante vlakke geometrie. Deze verbinding "ontvangt" methyljodide, CH3I, product van verzuring van CH3OH met 57% HI. Bij deze reactie wordt ook water geproduceerd en dankzij dit wordt uiteindelijk azijnzuur verkregen, terwijl het HI in de laatste stap kan worden teruggewonnen..
In deze stap zowel de groep -CH3 zoals -I binden ze aan het iridiummetaalcentrum (2), waardoor een octaëdrisch complex wordt gevormd met een facet dat bestaat uit drie liganden I. Een van de iodes wordt uiteindelijk vervangen door een molecuul koolmonoxide, CO; en nu (3) heeft het octaëdrische complex een facet dat is samengesteld uit drie CO-liganden.
Dan vindt er een herschikking plaats: de -CH-groep3 het maakt "los" van Ir en bindt zich aan aangrenzende CO (4) om een acetylgroep, -COCH, te vormen3. Deze groep komt vrij uit het iridiumcomplex om zich te binden aan jodide-ionen en CH te geven3COI, acetyljodide. Hier wordt de iridiumkatalysator teruggewonnen, klaar om deel te nemen aan een andere katalytische cyclus.
Eindelijk, de CH3IOC ondergaat een vervanging van de I- per molecuul H.tweeO, wiens mechanisme uiteindelijk HI en azijnzuur afgeeft.
Illegale syntheses

Te zien is dat eerst een substitutie van de OH-groep voor I optreedt, gevolgd door een tweede substitutie voor een H.
Referenties
- Wikipedia. (2019). Joodwaterstofzuur. Hersteld van: en.wikipedia.org
- Andrews, Natalie. (24 april 2017). Het gebruik van joodwaterstofzuur. Wetenschappelijk. Hersteld van: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydriodic zuur. Hersteld van: alfa.com
- Nationaal centrum voor informatie over biotechnologie. (2019). Hydriodic zuur. PubChem-database., CID = 24841. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Geïllustreerde verklarende woordenlijst van organische chemie: joodwaterstofzuur. Hersteld van: chem.ucla.edu
- Reusch William. (5 mei 2013). Koolhydraten. Hersteld van: 2. chemistry.msu.edu
- In Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Verminderd grafeenoxide door chemische grafitisering. DOI: 10.1038 / ncomms1067.



Niemand heeft nog op dit artikel gereageerd.