
Chemische kinetische factoren, reactievolgorde en toepassingen
De chemische kinetica Het is de studie van de reactiesnelheden. Leid experimentele of theoretische gegevens over het moleculaire mechanisme af door middel van wetten die worden uitgedrukt door wiskundige vergelijkingen. Mechanismen bestaan uit een reeks stappen, waarvan sommige snel zijn en andere langzaam..
De langzaamste hiervan wordt de snelheidsbepalende stap genoemd. Daarom is het in kinetische termen erg belangrijk om de tussenliggende soorten en het werkingsmechanisme van deze stap te kennen. Een visualisatie van het bovenstaande is om aan te nemen dat de reagentia in een fles zitten en dat bij reactie de producten naar buiten ontsnappen.

Ten slotte komen de producten vrij uit de opening van de fles zonder verdere kinetische belemmeringen. Vanuit dit perspectief zijn er flessen in vele maten en uitvoeringen. Ze hebben echter allemaal één element gemeen: een smalle hals, een indicator van de beslissende stap van de reactie..
Artikel index
- 1 Wat bestudeert chemische kinetiek?
- 2 Reactiesnelheid
- 2.1 Definitie
- 2.2 Algemene vergelijking
- 2.3 Dessertvoorbeeld
- 2.4 Hoe het te bepalen
- 3 factoren die de reactiesnelheid beïnvloeden
- 3.1 Aard van de chemische soorten
- 3.2 Concentratie van reagentia
- 3.3 Temperatuur
- 4 Reactie volgorde in chemische kinetiek
- 4.1 Zero-order reacties
- 4.2 Eerste orde reactie
- 4.3 Tweede orde reactie
- 4.4 Reactie volgorde versus molecuuliteit
- 5 Toepassingen
- 6 referenties
Wat bestudeert chemische kinetiek?
Experimenteel bestudeert deze tak van de chemie de concentratievariaties die betrokken zijn bij een chemische reactie, op basis van de meting van een specifieke eigenschap.
Chemische kinetiek is de tak van de chemie die verantwoordelijk is voor het bestuderen van alle informatie die kan worden afgeleid uit de snelheid van een reactie. Zijn naam nodigt uit om je een zakhorloge voor te stellen dat de tijd van een proces aangeeft, ongeacht waar het plaatsvindt: in een reactor, in een wolk, in een rivier, in het menselijk lichaam, enz..
Alle chemische reacties, en dus alle transformatie, hebben thermodynamische, evenwichts- en kinetische aspecten. Thermodynamica geeft aan of een reactie spontaan is of niet; het saldo de mate van kwantificering; en kinetiek de omstandigheden die de snelheid ervan bevorderen, en ook de gegevens over het mechanisme.
Veel van de essentiële aspecten van chemische kinetiek kunnen in het dagelijks leven worden waargenomen: in de koelkast, die voedsel bevriest om de ontbinding te verminderen door het water dat er deel van uitmaakt te bevriezen. Ook bij de rijping van de wijnen, waarvan de veroudering hem zijn aangename smaken geeft.
'De tijd van moleculen' is echter heel verschillend in zijn kleine schalen, en varieert enorm afhankelijk van vele factoren (aantal en soorten bindingen, afmetingen, toestanden van materie, enz.).
Omdat tijd leven is, en ook geld, is het van het grootste belang om te weten welke variabelen een chemische reactie zo snel mogelijk laten verlopen. Soms is echter het tegenovergestelde gewenst: dat de reactie heel langzaam verloopt, vooral als deze exotherm is en er explosiegevaar bestaat.
Wat zijn deze variabelen? Sommige zijn fysiek, zoals bij welke druk of temperatuur een reactor of systeem moet hebben; en andere zijn chemisch, zoals het type oplosmiddel, pH, zoutgehalte, moleculaire structuur, enz..
Voordat we deze variabelen vinden, moeten we echter eerst de kinetiek van de huidige reactie bestuderen.
Hoe? Door de variatie van de concentratie, die kan worden gevolgd als een bepaalde eigenschap die evenredig is met de eerste, wordt gekwantificeerd. Door de geschiedenis heen zijn de methoden geavanceerder geworden, waardoor nauwkeurigere en nauwkeurigere metingen mogelijk zijn, en met steeds kortere intervallen..
Reactiesnelheid
Om de snelheid van een chemische reactie te bepalen, is het noodzakelijk om te weten hoe de concentratie varieert in de tijd van elk van de betrokken soorten. Deze snelheid hangt in grote mate af van veel factoren, maar het belangrijkste is dat het meetbaar is voor die reacties die 'langzaam' plaatsvinden.
Het woord "langzaam" is hier relatief en wordt gedefinieerd voor alles wat met de beschikbare instrumentele technieken gemeten kan worden. Als de reactie bijvoorbeeld veel sneller is dan de meetcapaciteit van de apparatuur, dan is deze niet kwantitatief en kan de kinetiek ervan ook niet worden bestudeerd..
Vervolgens wordt de reactiesnelheid bepaald bij de drempel van elk proces voordat het evenwicht bereikt. Waarom? Omdat in evenwicht de snelheid van de voorwaartse reactie (productvorming) en die van de omgekeerde reactie (reactantvorming) hetzelfde zijn.
Door de variabelen die op het systeem inwerken, en bijgevolg de kinetiek of de reactiesnelheid, te regelen, kunnen de ideale omstandigheden worden gekozen om een bepaalde hoeveelheid product in de meest gewenste en veilige tijd te genereren..
Aan de andere kant onthult deze kennis het moleculaire mechanisme, dat waardevol is bij het verhogen van de opbrengst van een reactie..
Definitie
Snelheid is de verandering van een grootte als functie van de tijd. Bij deze onderzoeken ligt het belang bij het bepalen van de variatie van de concentratie naarmate de uren en minuten verstrijken; nano, pico of zelfs femtoseconden (10-vijftiens).
Je kunt veel eenheden hebben, maar de eenvoudigste en gemakkelijkste is M s-1, of wat gelijk is aan mol / L · s. Ongeacht de eenheden, het moet altijd een positieve waarde hebben, aangezien het een fysieke grootheid is (zoals afmetingen of massa).
Volgens afspraak hebben de verdwijningspercentages voor een reactant echter een negatief teken en die van het uiterlijk van een product een positief teken..
Maar als de reactanten en producten hun eigen snelheden hebben, hoe bepaal je dan de algehele reactiesnelheid? Het antwoord is in de stoichiometrische coëfficiënten.
Algemene vergelijking
De volgende chemische vergelijking geeft de reactie van A en B weer om C en D te vormen:
naarNAAR + bB => cC + dD
Molaire concentraties worden meestal uitgedrukt tussen vierkante haken, dus de concentratie van soort A wordt bijvoorbeeld geschreven als [A]. De reactiesnelheid voor elk van de betrokken chemische soorten is dus:
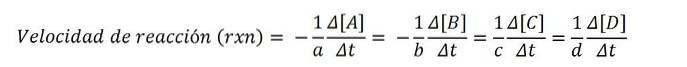
Volgens de wiskundige vergelijking zijn er vier routes om de reactiesnelheid te bereiken: de variatie in concentratie van elk van de reactanten (A of B) of van de producten (C of D) wordt gemeten..
Vervolgens, met een van deze waarden, en de juiste stoichiometrische coëfficiënt, delen door de laatste en om de reactiesnelheid rxn te verkrijgen.
Aangezien de reactiesnelheid een positieve grootheid is, vermenigvuldigt het negatieve teken de negatieve snelheidswaarden van de reactanten; om deze reden de coëfficiënten naar Y b vermenigvuldigen met (-1).
Als de verdwijningssnelheid van A bijvoorbeeld - (5M / s) is, en de stoichiometrische coëfficiënt naar is 2, dus de snelheid rxn is gelijk aan 2,5 M / s ((-1/2) x 5).
Dessert voorbeeld

Als het product een dessert was, zouden de ingrediënten naar analogie de reagentia zijn; en de chemische vergelijking, het recept:
7Koekjes + 3 brownies + 1 ijsje => 1 dessert
En de snelheden voor elk van de zoete ingrediënten en voor het dessert zelf zijn:
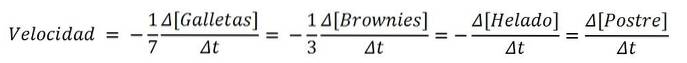
Zo kan de snelheid waarmee het dessert wordt gemaakt, worden bepaald door de variatie van ofwel de koekjes, de brownies, het ijs of de set zelf; vervolgens delen door zijn stoichiometrische coëfficiënten (7, 3, 1 en 1). Een van de routes kan echter gemakkelijker zijn dan de andere..
Als u bijvoorbeeld meet hoe [Dessert] stijgt met verschillende tijdsintervallen, kunnen deze metingen moeilijk zijn..
Aan de andere kant kan het handiger en praktischer zijn om [koekjes] te meten, vanwege hun aantal of enkele van hun eigenschappen waardoor hun concentratie gemakkelijker te bepalen is dan die van brownies of ijs..
Hoe het te bepalen
Gegeven de eenvoudige reactie A => B, als A, bijvoorbeeld in waterige oplossing, een groene kleur vertoont, dan is dit afhankelijk van de concentratie. Dus als A B wordt, verdwijnt de groene kleur, en als deze verdwijning wordt gekwantificeerd, kan een curve van [A] versus t worden verkregen.
Aan de andere kant, als B een zure soort is, zal de pH van de oplossing dalen tot waarden onder de 7. Dus uit de afname van de pH verkrijgen we [B], en achtereenvolgens de grafiek [B] versus t. Als we beide grafieken over elkaar heen leggen, kunnen we ongeveer het volgende zien:

In de grafiek kunnen we zien hoe [A] afneemt met de tijd, omdat het wordt verbruikt, en hoe de curve [B] toeneemt met een positieve helling omdat het het product is.
Het is ook te zien dat [A] neigt naar nul (als er geen evenwicht is) en dat [B] een maximale waarde bereikt die wordt bepaald door stoichiometrie en als de reactie voltooid is (alle A is verbruikt).
De reactiesnelheid van zowel A als B is de raaklijn op een van deze krommen; met andere woorden, de afgeleide.
Factoren die de reactiesnelheid beïnvloeden
Aard van de chemische soorten
Als alle chemische reacties ogenblikkelijk zouden zijn, zouden hun kinetische studies niet bestaan. Velen hebben zo hoge snelheden dat ze niet kunnen worden gemeten; dat wil zeggen, ze zijn niet meetbaar.
De reacties tussen de ionen zijn dus meestal erg snel en volledig (met een opbrengst van ongeveer 100%). Aan de andere kant hebben die met organische verbindingen enige tijd nodig. Een reactie van het eerste type is:
H.tweeSW4 + 2NaOH => NatweeSW4 + 2HtweeOF
De sterke elektrostatische interacties tussen de ionen bevorderen de snelle vorming van water en natriumsulfaat. In plaats daarvan is een reactie van het tweede type bijvoorbeeld de verestering van azijnzuur:
CH3COOH + CH3CHtweeOH => CH3COOCHtweeCH3 + H.tweeOF
Hoewel er ook water wordt gevormd, is de reactie niet onmiddellijk; zelfs onder gunstige omstandigheden duurt het enkele uren om te voltooien.
Andere variabelen hebben echter meer invloed op de reactiesnelheid: concentratie van reactanten, temperatuur, druk en aanwezigheid van katalysatoren..
Reagens concentratie
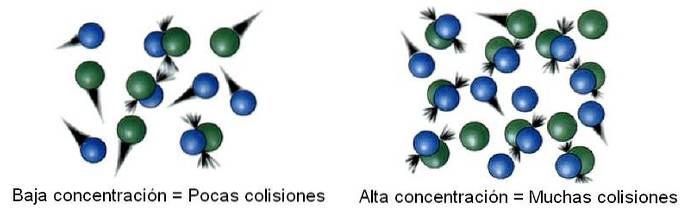
In de chemische kinetiek wordt de ruimte die wordt bestudeerd, gescheiden van oneindig, een systeem genoemd. Een reactor, een bekerglas, een kolf, een wolk, een ster, enz. Kunnen bijvoorbeeld worden beschouwd als het onderzochte systeem..
Binnen het systeem zijn de moleculen dus niet statisch, maar "reizen" ze naar al zijn hoeken. Bij sommige van deze verplaatsingen botst het met een ander molecuul om terug te stuiteren of producten te produceren..
Het aantal botsingen is dan evenredig met de concentratie van de reactanten. Bovenstaande afbeelding illustreert hoe het systeem verandert van lage naar hoge concentraties.
Hoe meer botsingen er zijn, hoe sneller de reactiesnelheid, omdat de kans dat twee moleculen reageren groter wordt..
Als de reactanten gasvormig zijn, wordt de drukvariabele gehanteerd en gerelateerd aan de gasconcentratie, uitgaande van een van de vele bestaande vergelijkingen (zoals die van het ideale gas); of ook wordt het volume van het systeem verkleind om de kans te vergroten dat de gasvormige moleculen botsen.
Temperatuur
Hoewel het aantal botsingen toeneemt, hebben niet alle moleculen de energie die nodig is om de activeringsenergie van het proces te overschrijden.
Hier speelt temperatuur een belangrijke rol: het vervult de functie van het thermisch versnellen van de moleculen zodat ze met meer energie botsen..
De reactiesnelheid verdubbelt dus in het algemeen voor elke 10 ° C stijging van de systeemtemperatuur. Dit is echter niet bij alle reacties het geval. Hoe deze toename te voorspellen? De vergelijking van Arrhenius beantwoordt de vraag:
d (lnK) / dT = E / (RTtwee
K is de snelheidsconstante bij temperatuur T, R is de gasconstante en E is de activeringsenergie. Deze energie is een indicatie van de energiebarrière die de reactanten moeten schalen om te reageren..
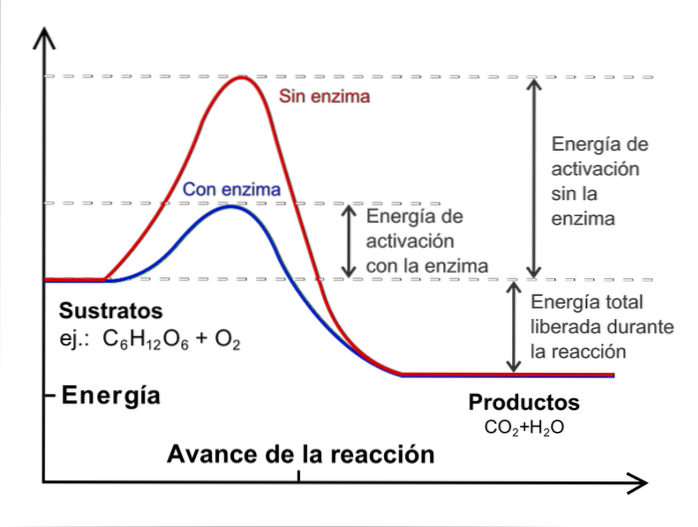
Om een kinetische studie uit te voeren, is het noodzakelijk om de temperatuur constant en zonder katalysatoren te houden. Wat zijn katalysatoren? Het zijn externe soorten die in de reactie tussenkomen, maar niet worden geconsumeerd, en die de activeringsenergie verminderen.
De afbeelding hierboven illustreert het concept van katalyse voor de reactie van glucose met zuurstof. De rode lijn geeft de activeringsenergie weer zonder het enzym (biologische katalysator), terwijl daarmee de blauwe lijn een afname van de activeringsenergie laat zien.
Reactie volgorde in chemische kinetiek
In een chemische vergelijking zijn de stoichiometrische indices, gerelateerd aan het reactiemechanisme, niet gelijk aan de indices van dezelfde orde. Chemische reacties hebben meestal de eerste of tweede orde, zelden de derde orde of hoger..
Voor wat is dit? Omdat de botsingen van drie energetisch geëxciteerde moleculen onwaarschijnlijk zijn, en nog meer zijn er viervoudige of vijfvoudige botsingen, waarbij de kans oneindig klein is. Fractionele reactieorders zijn ook mogelijk. Bijvoorbeeld:
NH4Cl <=>NH3 + HCl
De reactie is in de ene zin van de eerste orde (van links naar rechts) en de tweede orde in de andere (van rechts naar links) als het als een evenwicht wordt beschouwd. Terwijl het volgende evenwicht in beide richtingen van de tweede orde is:
2HI <=> H.twee + iktwee
Zijn moleculaire eigenschappen en volgorde van reacties hetzelfde? Nee. Moleculariteit is het aantal moleculen dat reageert om producten voort te brengen, en de algehele volgorde van de reactie is dezelfde volgorde van de reactanten die betrokken zijn bij de bepalingssnelheid..
2KMnO4 + 10KI + 8HtweeSW4 => 2MnSO4 + 5Itwee + 6KtweeSW4 + 8HtweeOF
Deze reactie is, ondanks hoge stoichiometrische indices (molecuuliteit), in feite een reactie van de tweede orde. Met andere woorden, de bepalende stap van de snelheid is van de tweede orde.
Zero order reacties
Ze komen voor bij heterogene reacties. Bijvoorbeeld: tussen een vloeistof en een vaste stof. De snelheid is dus onafhankelijk van de concentraties van de reactanten.
Evenzo, als een reactant een reactieorde van nul heeft, betekent dit dat hij niet deelneemt aan de bepalende stap van de snelheid, maar aan de snelle.
Reactie van de eerste orde
A => B
Een eerste-orde-reactie wordt beheerst door de volgende tariefwet:
V = k [A]
Als de concentratie van A verdubbelt, verdubbelt de reactiesnelheid V. Daarom is de snelheid evenredig met de concentratie van het reagens in de bepalende stap van de reactie..
Reactie van de tweede orde
2A => B
A + B => C
Bij dit type reactie zijn twee soorten betrokken, net als bij de twee zojuist geschreven chemische vergelijkingen. De tariefwetten voor de reacties zijn:
V = k [A]twee
V = k [A] [B]
In de eerste is de reactiesnelheid evenredig met het kwadraat van de concentratie van A, terwijl in de tweede hetzelfde gebeurt als in de eerste orde reacties: de snelheid is recht evenredig met de concentraties van zowel A als B.
Reactie volgorde versus molecuuliteit
Volgens het vorige voorbeeld kunnen de stoichiometrische coëfficiënten al dan niet samenvallen met de volgorde van de reactie.
Dit gebeurt echter wel voor elementaire reacties, die het moleculaire mechanisme van elke stap in een reactie bepalen. Bij deze reacties zijn de coëfficiënten gelijk aan het aantal deelnemende moleculen.
Een molecuul A reageert bijvoorbeeld met een van B om een molecuul C te vormen. Hier is de molecuuliteit 1 voor de reactanten en dan vallen ze in de uitdrukking van de snelheidswet samen met de reactieorden.
Hieruit volgt dat de molecuuliteit altijd een geheel getal moet zijn, en waarschijnlijk minder dan vier.
Waarom? Omdat het bij het passeren van een mechanisme zeer onwaarschijnlijk is dat vier moleculen tegelijkertijd deelnemen; twee van hen zouden eerst kunnen reageren, en dan zouden de resterende twee met dit product reageren.
Wiskundig gezien is dit een van de belangrijkste verschillen tussen reactieorden en molecuulgewicht: een reactieorde kan fractionele waarden aannemen (1/2, 5/2, etc.).
Dit komt omdat de eerste alleen weergeeft hoe de concentratie van de soort de snelheid beïnvloedt, maar niet hoe hun moleculen in het proces tussenkomen..
Toepassingen
- Hiermee kan worden bepaald hoe lang een medicijn in het lichaam blijft voordat het volledig wordt gemetaboliseerd. Evenzo, dankzij kinetische studies, kan enzymatische katalyse worden gevolgd als groene methoden in vergelijking met andere katalysatoren met negatieve gevolgen voor het milieu; of ook te gebruiken in talloze industriële processen.
- In de auto-industrie, met name in motoren, waar elektrochemische reacties snel moeten worden uitgevoerd om het voertuig te laten starten. Ook in de uitlaatpijpen, die katalysatoren hebben om de schadelijke gassen CO, NO en NO om te zetten.X in COtwee, H.tweeAANtwee metwee tijdens de optimale tijd.
2NaN3(s) = 2Na (s) + 3Ntwee(g)
-Het is de reactie achter waarom airbags, de 'airbags', worden opgeblazen wanneer voertuigen met elkaar in botsing komen. Wanneer de banden op de rem slaan, brengt een detector het natriumazide, NaN, elektrisch tot ontploffing3. Dit reagens "explodeert" waarbij N vrijkomttwee, die snel het volledige volume van de tas inneemt.
Metallisch natrium reageert dan met andere componenten om het te neutraliseren, omdat het in zijn pure staat giftig is.
Referenties
- Walter J. Moore. (1963). Fysische chemie. In Chemische kinetica. Vierde editie, Longmans.
- Ira N. Levine. (2009). Principes van fysicochemie. Zesde editie, blz. 479-540. Mc Graw Hill.
- UAwiki. (23 december 2011). Moleculaire botsingen zijn. [Figuur]. Opgehaald op 30 april 2018, van: es.m.wikipedia.org
- Glasstone. (1970). Leerboek van fysische chemie. In Chemische kinetica. Tweede druk. D. Van Nostrand, Company, Inc.
- Anne Marie Helmenstine, Ph.D. (8 maart 2017). Definitie van chemische kinetiek. Opgehaald op 30 april 2018, van: thoughtco.com
- Khan Academy. (2018). Reactiesnelheid en tariefwetten. Opgehaald op 30 april 2018, van: khanacademy.org
- Germán Fernández. (26 juli 2010). Chemische kinetica. Opgehaald op 30 april 2018, van: quimicafisica.com



Niemand heeft nog op dit artikel gereageerd.