
Cytochroom-c-oxidase-structuur, functies, remmers
De cytochroom c oxidase Het is een complex van enzymatische eiwitten die de lipidedubbellaag van het celmembraan kunnen passeren. Het is hemosoplosbaar en wordt voornamelijk geassocieerd met het binnenmembraan van de mitochondriën, dat zowel in prokaryote organismen (bacteriën) als in eukaryoten (eencellig en meercellig) wordt aangetroffen..
Dit enzym, ook wel complex IV genoemd, is essentieel in de aërobe metabolische functies van organismen, omdat het essentieel is in de elektronentransportketen waarin de cel suikers verbrandt en een deel van de energie opvangt die vrijkomt om adenosinetrifosfaat of ATP op te slaan..
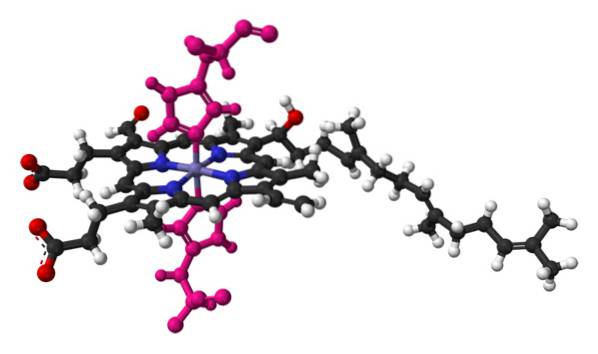
De naam cytochroom betekent "cellulaire pigmenten". Dit zijn bloedeiwitten die elektronen vervoeren. Cytochromen werden ontdekt door de Ierse arts Charles Alexander MacMunn in 1884. MacMunn was een pionier in de ontdekking van het ademhalingspigment in het bloed, tegenwoordig cytochroom 1 genoemd..
In de jaren twintig herontdekte en karakteriseerde de Russische entomoloog en parasitoloog David Keilin ademhalingspigmenten en was degene die ze cytochromen noemde. Hoewel MacMunn ze in 1884 had ontdekt, was de wetenschappelijke gemeenschap hem vergeten en sommigen hadden zijn werk zelfs verkeerd geïnterpreteerd..
Artikel index
- 1 Algemene kenmerken
- 1.1 -Cytochroom c
- 2 Cytochroom c oxidase of Complex IV
- 3 Structuur
- 4 functies
- 4.1 Apoptose of geprogrammeerde celdood
- 4.2 Regeneratie van cellen of weefsels
- 4.3 Energiemetabolisme
- 5 remmers
- 6 Tekort
- 7 Gebruikt in fylogenie
- 8 referenties
Algemene karakteristieken
In het algemeen hebben ademhalingspigmenten karakteristieke spectra van zichtbaar licht. Het is bekend dat er ten minste vier integrale membraaneiwitcomplexen zijn met 5 verschillende soorten cytochromen: a, a3, b, c1 en c, geclassificeerd volgens de golflengten van de spectrale absorptiemaxima..
Ze worden meestal aangetroffen op het binnenmembraan van de mitochondriën. Ze zijn echter ook waargenomen in het endoplasmatisch reticulum en chloroplasten, in eukaryote en prokaryote organismen..
Ze presenteren de heemprothetische groep die ijzer (Fe) bevat. Elk van de bekende cytochromen werkt in multienzymcomplexen bij het transport van elektronen in het ademhalingsproces of de ademhalingsketen..
Cytochromen hebben de functie om deel te nemen aan oxidatiereductiereacties. Reductiereacties, waarbij ze elektronen accepteren, treden anders op voor elk type cytochroom en hun waarde wordt bepaald door de stroom van elektronen uit de ademhalingsketen.
-Cytochroom c
Er zijn vier klassen cytochroom c bekend, die als volgt zijn.
Klasse I
Binnen deze klasse vallen de oplosbare low-spin cytochromen c (lowspin), aanwezig in bacteriën en mitochondriën. Ze zijn octaëdrisch. De heem-bindingsplaats bevindt zich aan het N-uiteinde van histidine en het zesde ligand wordt geleverd door een methionineresidu aan het C-uiteinde..
Van deze klasse zijn zelfs meerdere subklassen te herkennen, waarvan de driedimensionale structuur is bepaald..
Klasse II
Cytochroom c met hoge spin en cytochroom c met lage spin worden in deze klasse aangetroffen. De high-turn degenen hebben de bindingsplaats dichtbij de C-terminus, en in de low-turn degenen lijkt de zesde ligand een methionineresidu te zijn nabij de N-terminus. Ze zijn vijfvoudig gecoördineerd met histidine van de vijfde ligand.
Klasse III
Deze klasse wordt gekenmerkt door het presenteren van cytochromen c met meerdere heem (c3 en c7) en een laag oxideverminderend vermogen, met slechts 30 aminozuurresiduen per heemgroep. In vertegenwoordigers van deze klasse hebben heem-groepen niet-equivalente structuur en functies, naast het presenteren van verschillende redoxpotentialen. Ze zijn octaëdrisch.
Klasse IV
Volgens sommige auteurs is deze klasse gemaakt om alleen complexe eiwitten te omvatten die andere prothetische groepen aanwezig zijn, evenals heem c of flavocytochroom c, onder andere..
Cytochroom c oxidase of Complex IV
Cytochroom c oxidase is een mitochondriaal enzym dat de laatste fase van elektronentransport in cellulaire ademhaling uitvoert. Dit enzym katalyseert het transport van elektronen van gereduceerd cytochroom c naar zuurstof..
Sommige chemische verbindingen, zoals cyanide, kooldioxide en azide, kunnen de werking van dit enzym remmen, waardoor de zogenaamde cellulaire chemische verstikking ontstaat. Andere vormen van remming van complex IV zijn genetische mutaties.
Vanuit evolutionair oogpunt wordt cytochroom c-oxidase alleen aangetroffen in aërobe organismen, en verschillende groepen wetenschappers suggereren dat de aanwezigheid van dit eiwit wijst op evolutionaire relaties waarin planten, schimmels en ook dieren een gemeenschappelijke voorouder deelden..
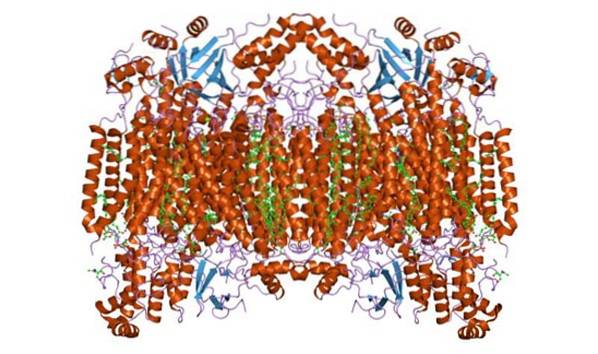
Structuur
Cytochroom-c-oxidase vormt een homodimeer complex, dat wil zeggen samengesteld uit twee vergelijkbare monomeren in het binnenmembraan van de mitochondriën. Het enzymcomplex bestaat uit 3 tot 4 subeenheden in prokaryote organismen en tot maximaal 13 (sommige suggereren 14) polypeptiden in organismen zoals zoogdieren..
Bij deze organismen zijn 3 polypeptiden van mitochondriale oorsprong en de rest vindt zijn oorsprong in de kern. Elk monomeer heeft 28 transmembraanhelices die hydrofiele domeinen scheiden tegen de membraanmatrix en de intermembraanruimte..
Het heeft een enkele katalytische eenheid, die wordt aangetroffen in alle enzymen die oxidatie- / reductiereacties katalyseren, met behulp van moleculaire zuurstof (oxidasen, vooral heem-koper). Het complex bevat cytochromen a en a3 verbonden door subeenheid I en twee kopercentra.
Het heeft een of meer heem-C-groepen die zijn verbonden met de omringende eiwitstructuur door een of meer (meestal twee) thioetherbindingen. Andere auteurs suggereren dat er een enkele heem-C-groep is die covalent is gekoppeld aan het eiwit tussen de porfyrinering en twee cysteïneresiduen..
De enige hierboven genoemde heem c-groep is omgeven door hydrofobe residuen en is hexa-gecoördineerd, met histidine op positie 18 van de polypeptideketen en methionine op positie 80..
Kenmerken
Cytochroom c oxidasen zijn protagonisten in drie belangrijke fysiologische mechanismen, die we hieronder zullen zien.
Apoptose of geprogrammeerde celdood
Apoptose is geprogrammeerde celvernietiging of dood, veroorzaakt door het organisme zelf en waarvan het doel is om de groei, ontwikkeling, de eliminatie van beschadigde weefsels en de regulering van het immuunsysteem te beheersen. In dit fysiologische proces neemt cytochroom c-oxidase deel als tussenproduct.
Dit eiwit, afgegeven door de mitochondriën, leidt tot een interactie met het endoplasmatisch reticulum, dat de uitscheiding of afgifte van calcium veroorzaakt. De progressieve toename van calcium veroorzaakt een massale afgifte van cytochroom c-oxidase, totdat cytotoxische calciumspiegels worden bereikt..
Cytotoxische calciumspiegels en het vrijkomen van cytochromen c veroorzaken de cascade-activering van verschillende caspase-enzymen, die verantwoordelijk zijn voor de vernietiging van cellen.
Cel- of weefselregeneratie
Verschillende onderzoeken tonen aan dat wanneer cytochroom-c-oxidase wordt blootgesteld aan golflengten van 670 nanometer, het deelneemt aan een functioneel complex dat beschadigd of beschadigd weefsel binnendringt en de celregeneratie versnelt..
Energiemetabolisme
Dit is misschien wel de bekendste en meest relevante functie van cytochroom c-oxidase. Het is precies het oxidasecomplex (van de ademhalingsketen) dat verantwoordelijk is voor het verzamelen van de elektronen van cytochroom c en deze overbrengt naar het zuurstofmolecuul, waardoor het wordt gereduceerd tot twee watermoleculen..
Verbonden met dit proces vindt een translocatie van protonen plaats door het membraan, wat resulteert in het genereren van een elektrochemische gradiënt die het ATP-synthetasecomplex gebruikt om ATP (adenosinetrifosfaat) te produceren of te synthetiseren..
Remmers
Cytochroom-c-oxidase wordt geremd door verschillende chemische verbindingen en processen. De manier waarop het optreedt, kan ontstaan als een natuurlijke manier om de productie of werking van het enzym te reguleren of het kan per ongeluk optreden als gevolg van vergiftiging.
In aanwezigheid van azide, cyanide of koolmonoxide bindt cytochroom c oxidase hieraan en wordt de werking van het eiwitcomplex geremd. Dit veroorzaakt een onderbreking van het cellulaire ademhalingsproces en veroorzaakt daardoor de chemische verstikking van de cellen..
Andere verbindingen, zoals stikstofmonoxide, waterstofsulfide, methanol en sommige gemethyleerde alcoholen, veroorzaken ook remming van cytochroom-c-oxidase..
Tekort
Cytochroom c-oxidase is een enzym dat wordt gecontroleerd door genen in zowel de kern als de mitochondriën. Er zijn genetische veranderingen of mutaties die kunnen leiden tot een tekort aan cytochroom-c-oxidase.
Deze mutaties verstoren de functionaliteit van het enzym, omdat ze de enzymatische structuur ervan veranderen en metabole stoornissen veroorzaken tijdens de embryonale ontwikkeling (volgens studies bij mensen), die later het organisme in zijn eerste levensjaren zullen aantasten..
Cytochroom-c-oxidase-deficiëntie treft weefsels met een hoge energiebehoefte, zoals het hart, de lever, de hersenen en de spieren. De symptomen van deze mutaties worden weerspiegeld vóór de twee levensjaren en kunnen zich manifesteren als sterke of milde aandoeningen.
Milde symptomen kunnen zelfs kort na het eerste levensjaar worden waargenomen, en personen met hen hebben meestal alleen verminderde spierspanning (hypotonie) en spieratrofie (myopathie)..
Aan de andere kant kunnen personen met sterkere symptomen spieratrofie en encefalomyopathie hebben. Andere aandoeningen die worden veroorzaakt door de afwezigheid van cytochroom c-oxidase zijn hypertrofische cardiomyopathie, pathologische vergroting van de lever, het syndroom van Leigh en melkzuuracidose..
Gebruikt in fylogenie
Fylogenie is de wetenschap die verantwoordelijk is voor de studie van de oorsprong, vorming en evolutionaire ontwikkeling vanuit het oogpunt van voorouder en afstammeling, van organismen. In de afgelopen decennia zijn fylogenetische studies met moleculaire analyse steeds vaker voorgekomen, wat veel informatie opleverde en taxonomische problemen oplost..
In die zin geven sommige fylogenetische studies aan dat het gebruik van cytochroom c oxidasen kan helpen bij het leggen van evolutionaire relaties. Dit komt doordat dit eiwitcomplex sterk geconserveerd is en aanwezig is in een grote verscheidenheid aan organismen, variërend van eencellige protisten tot grote gewervelde dieren..
Een voorbeeld hiervan zijn de tests met mensen, chimpansees (Paniscus brood) en resusaapjes (Macaca-mulattaDergelijke tests toonden aan dat cytochroom-c-oxidase-moleculen van mensen en chimpansees identiek waren..
Het toonde ook aan dat de cytochroom-c-oxidase-moleculen van de resusaap een aminozuur verschilden van die van de eerste twee, waardoor de voorouder-afstammeling-relaties tussen chimpansees en mensen opnieuw werden bevestigd..
Referenties
- R.P. Ambler (1991). Sequentievariabiliteit in bacteriële cytochromen c. Biochimica et Biophysica Acta (BBA) - Bio-energetica.
- Cytochroom c. Opgehaald van newworldencyclopedia.org.
- V. Colman, E. Costa, R. Chaves, V. Tórtora (2015). Biologische rollen van cytochroom c: mitochondriaal elektronentransport, geprogrammeerde celdood en toename van peroxide-activiteit. Annalen van de Faculteit Geneeskunde.
- Cytochroom c oxidase subeenheid I. Hersteld van ebi.ac.uk.
- L. Youfen, P. Jeong-Soon, D. Jian-Hong & B. Yidong (2007). Cytochroom c-oxidase subeenheid IV is essentieel voor de assemblage en ademhalingsfunctie van het enzymcomplex. Journal of Bioenergetics and Biomembranes.
- Gengroep: mitochondriaal complex IV: cytochroom c oxidase-subeenheden (COX, MT-CO). Opgehaald van genenames.org.
- E.F. Hartree (1973). De ontdekking van cytochroom. Biochemisch onderwijs.
- Cytochroom c oxidase, tekort aan…. Opgehaald van ivami.com.
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemestry. 3e editie. Benjamin / Cummings Publishing Company, Inc.


Niemand heeft nog op dit artikel gereageerd.