
Molariteitsconcentratie, eenheden, berekening, oefeningen
De molariteit is de concentratie van een oplossing uitgedrukt in mol opgeloste stof per liter oplossing. Het wordt afgekort als M en drukt een relatie uit tussen de massa van de opgeloste stof en het volume van de oplossing (m / v); hoewel traditioneel deze relatie wordt uitgedrukt als gewicht tot volume.
Een mol is het aantal atomen of moleculen in het atoom- of molecuulgewicht; Het wordt uitgedrukt in gram / mol. Een mol is gelijk aan 6,02 · 102. 3 atomen of moleculen, bekend als het getal van Avogadro.
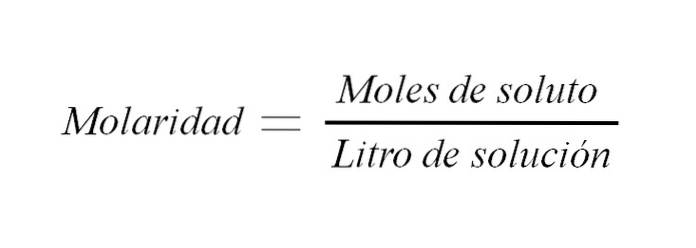
Er zijn andere manieren om de relatie tussen de massa van een opgeloste stof en het volume uit te drukken, waaronder: de procentuele relatie tussen de massa van de opgeloste stof en het volume van de oplossing, en normaliteit. Dit laatste wordt uitgedrukt als het aantal equivalenten van een opgeloste stof per liter oplossing.
Ondertussen drukt molaliteit, dat wordt gedefinieerd als het aantal mol per kilogram oplosmiddel, meestal water, een verband uit tussen de massa van de opgeloste stof en de massa van het oplosmiddel (m / m)..
De uitdrukkingsvorm van de concentratie van een oplossing in delen per miljoen (ppm), drukt een verband uit tussen een deel van de opgeloste stof en een miljoen delen van de oplossing, en wordt over het algemeen gebruikt om een massa-massa-relatie uit te drukken (m / m) . Maar je kunt een massa-volume-relatie uitdrukken (m / v).
De molaire concentratie kan niet alleen worden uitgedrukt in mol per liter, maar ook in millimol / liter (millimolaire oplossing); micromol / liter (micromolaire oplossing); enz.
Molariteitsproblemen kunnen worden opgelost met behulp van een analytische methode en door gebruik te maken van de "regel van drie". De keuze van een methode hangt af van de vaardigheid die je hebt in het gebruik van een van de methoden.
Artikel index
- 1 molaire concentratie
- 2 eenheden
- 3 Hoe molariteit te berekenen?
- 4 Ga van molariteit naar molaliteit
- 4.1 Eerste stap
- 4.2 Tweede stap
- 4.3 Derde stap
- 4.4 Vierde stap
- 4.5 Vijfde stap
- 4.6 Numeriek voorbeeld
- 5 problemen opgelost
- 5.1 Probleem 1
- 5.2 Probleem 2
- 5.3 Probleem 3
- 5.4 Probleem 4
- 5.5 Probleem 5
- 6 referenties
Molaire concentratie
Het wordt gebruikt om de concentratie van een opgeloste stof in een bepaald volume oplossing uit te drukken.
M = n / V (1)
Waar M gelijk is aan molariteit, is n het aantal mol en V is het volume van de oplossing. De molariteit van een oplossing is dus het aantal mol opgeloste stof per volume oplossing uitgedrukt in liters.
Aan de andere kant is het aantal moedervlekken
n = m / PM (2)
Waarbij m de massa van de opgeloste opgeloste stof is en PM de molaire massa.
Vervanging van (2) in (1):
M = (m / PM) / V
Eenheden
De eenheid in het internationale systeem voor molaire concentratie is mol / m3. Dit komt overeen met een millimolaire oplossing, omdat am3 is gelijk aan 1.000 liter. In de takken van chemie en biologie wordt de molaire concentratie meestal uitgedrukt als mollen / L. Deze eenheid wordt uitgedrukt met de M (hoofdletter).
Een oplossing van één mol / L is equivalent aan een oplossing M; een oplossing van 10-3 mol / L, gelijk aan 1 mM (millimolair); en een oplossing van 10-6 mol / L, is gelijk aan 1 µM (micromolair).
Hoe molariteit te berekenen?
Het is handig om de hierboven aangegeven uitdrukkingen te gebruiken, omdat dit ervoor zorgt dat het resultaat van het toepassen van de formule in mol / liter wordt weergegeven, wat de definitie is van molaire concentratie.
Om de molariteit van een oplossing te berekenen, is het dan nodig om de concentratie van de opgeloste stof in g / l uit te drukken. Zoek vervolgens het molecuulgewicht van de opgeloste stof (g / mol) en zoek de verhouding tussen de concentratie en het molecuulgewicht. Het verkregen resultaat is de molariteit uitgedrukt in mol / liter.
Ga van molariteit naar molaliteit
Een noodzakelijke informatie om van molariteit naar molaliteit te gaan, is de dichtheid van de oplossing te kennen. Dit maakt het mogelijk om de massa van de oplossing te kennen, een essentiële vereiste voor het berekenen van de molaliteit..
Eerste stap
Eerst moet je van de molaire concentratie naar gram / liter gaan. Om dit te doen, volstaat het om de molariteit van de oplossing te vermenigvuldigen met het molecuulgewicht van de opgeloste stof..
Gram / liter opgeloste stof = molariteit (mol / liter) · molecuulgewicht van de opgeloste stof (gram / mol).
Dit maakt het mogelijk om de massa van de opgeloste stof in 1 L oplossing te verkrijgen.
Tweede stap
Dan is het nodig om de massa van de oplossing te berekenen. Hiervoor wordt de dichtheid ervan gebruikt. Meestal wordt de dichtheid uitgedrukt in gram / kubieke centimeter of milliliter.
Massa van de oplossing (g) = volume van de oplossing (ml) dichtheid (g / ml)
Derde stap
Het verkrijgen van de massa van het oplosmiddel. Aangezien de massa van de oplossing gelijk is aan de massa van de opgeloste stof plus de massa van het oplosmiddel, is het voldoende om de massa van de opgeloste stof (stap 1) af te trekken van de massa van de oplossing ( stap 2)..
Vierde stap
Ten slotte moet de opgeloste massa (g) van de oplossing worden overgebracht naar de opgeloste massa die overeenkomt met 1.000 g of 1 kg oplosmiddel. Om dit te doen, zou het voldoende zijn om een eenvoudige regel van drie of een andere gelijkwaardige wiskundige bewerking uit te voeren.
Vijfde stap
Verdeel g opgeloste stof / 1000 g oplosmiddel door het molecuulgewicht van de opgeloste stof (g / mol) om de molaliteit van de oplossing te verkrijgen.
Numeriek voorbeeld
Een glucoseoplossing van 3 M (molecuulgewicht 180 g / mol) heeft een dichtheid van 1,15 g / ml. Bereken de molaliteit van deze oplossing.
We berekenen eerst het aantal gram glucose opgelost in een liter oplossing:
g / L = 3 mol / L 180 g / mol
= 540 g / l
Vervolgens berekenen we de massa van de oplossing op basis van de dichtheid:
g oplossing (massa) = 1.000 ml 1,15 g / ml
= 1150 g
De massa van het oplosmiddel wordt gegeven door het verschil:
Massa van oplosmiddel = massa van oplossing - massa van opgeloste stof
= 1150 g - 540 g
= 610 g
Maar 610 g is niet 1000 g oplosmiddel zoals bepaald door de definitie van molaliteit. Daarom moet worden berekend hoeveel gram glucose is opgelost in 1000 g oplosmiddel:
Massa opgeloste stof = 540 g opgeloste stof (1.000 g oplosmiddel / 610 g oplosmiddel)
= 885,25 g
En tot slot wordt de molaliteit berekend door de grammen terug te geven aan mollen:
Molaliteit = (885,25 g opgeloste stof / 180 g / mol)
= 4,92 mol opgeloste stof / kg oplosmiddel
= 4,92 m
Problemen opgelost
Probleem 1
Hoeveel koper (II) sulfaat is er nodig om 500 ml van een 0,4 M-oplossing te bereiden? Druk het resultaat uit in grammen. Molecuulgewicht van koper (II) sulfaat (CuSO4): 160 g / mol.
We bepalen eerst de mollen die in zo'n oplossing moeten worden opgelost:
M = n / V
n = M V
n = (0,4 mol / l) 0,5 l
= 0,2 mol
Als u dan het aantal mol koper (II) sulfaat weet, kan de massa ervan worden verkregen
n = m / PM
m = nmoleculair gewicht
m = 0,2 mol 160 g / mol
= 32 g CuSO4
Dat wil zeggen, 32 gram van dit zout moet worden opgelost in 500 ml oplosmiddel.
Probleem 2
Welk volume van een oplossing is nodig zodat wanneer 0,4 mol opgeloste stof oplost, deze een concentratie heeft van 0,25 M?
Het volume van de oplossing wordt verkregen uit het concept van molariteit
M = n / V
V = n / M
V = 0,4 mol / (0,25 mol / L)
= 1,6 L
Het betekent dat de oplossing een inhoud van 1,6 liter moet hebben om een dergelijke concentratie van 0,25 M te verkrijgen.
Probleem 3
Een massa van 8 g natriumhydroxide (NaOH) wordt opgelost in 60 g van een oplossing met een dichtheid van 1,6 g / ml. Wat is de molariteit van de oplossing? Molecuulgewicht natriumhydroxide: 40 g / mol.
De mol NaOH moet eerst worden berekend:
n = m / PM
= 8 g natriumhydroxide / (40 g / mol)
= 0,2 mol
Nu gaan we verder met het berekenen van het volume van de oplossing:
m = V d
v = 60 g / (1,6 g / ml)
v = 37,5 ml
Om de molariteit te verkrijgen, moet het volume van de oplossing in liters worden geplaatst:
V = 37,5 ml 10-3 L / ml
= 0,0375 L
M = 0,2 mol / 0,0375 L.
5,33 mol / l
5,33 M
Probleem 4
Bereken de molariteit van een zoutzuuroplossing (HCl) met een dichtheid van 1,25 g / ml en een concentratie van 35%, uitgedrukt in massa / massa. Molecuulgewicht zoutzuur: 36,5 g / mol.
Bepaal de massa van 35% zoutzuur
m = V d
m = 1.000 ml 1,25 g / ml
= 1250 g
Maar niet alles is HCl, er is ook water:
massa HCl = 1250 g (35/100)
= 437,5 g
Dat is hetzelfde als zeggen dat er in een liter 35% HCl-oplossing 437,5 gram HCl zit.
Vervolgens worden de mol HCl berekend om de molariteit onmiddellijk te bepalen:
n = m / PM
n = (437,5 g / l) / (36,5 g / mol)
= 11,98 mol / L
Molariteit = 11,98 M
Probleem 5
Bereken de molariteit van een oplossing met 5 g NaCl in 2 L oplossing. Molecuulgewicht natriumchloride: 58,5 g / mol.
De mol / l NaCl kan in een enkele stap worden verkregen:
molariteit = (5 g NaCl / 2 L-oplossing) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 mol / L
Molariteit = 0,043 M
Een andere procedure zou kunnen zijn:
g / l NaCl = 5 g / 2 l
= 2,5 g / l
mol / l = (2,5 g / l) / (58,5 g / mol)
= 0,043 mol / L
= 0,043 M
Referenties
- Rodríguez, M. (2007). Chemie. Salesiaanse redactionele stichting
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2019). Molariteit Hersteld van: es.wikipedia.org
- Atarés Huerta. (s.f.). Molariteit en molaliteit. [Pdf]. Hersteld van: riunet.upv.es
- Softchools. (2019). Molariteits formule. Hersteld van: softschools.com



Niemand heeft nog op dit artikel gereageerd.