
Chloorgeschiedenis, eigenschappen, structuur, risico's, gebruik
De chloor- Het is een chemisch element dat wordt weergegeven door het symbool Cl.Het is de tweede van de halogenen, gelegen onder fluor, en is ook het derde meest elektronegatieve element van allemaal. De naam is afgeleid van de geelgroene kleur, die intenser is dan fluoride.
In de volksmond, als iemand je naam hoort, is het eerste waar ze aan denken de bleekproducten voor kleding en het water in zwembaden. Hoewel chloor in dergelijke voorbeelden effectief werkt, is het niet zijn gas, maar zijn verbindingen (vooral hypochloriet) die de blekende en desinfecterende werking uitoefenen..

De afbeelding hierboven toont een ronde kolf met chloorgas. De dichtheid is groter dan die van lucht, wat verklaart waarom het in de kolf blijft en niet in de atmosfeer ontsnapt; zoals het gebeurt met andere lichtere gassen, om te zeggen helium of stikstof. In deze toestand is het een zeer giftige stof, omdat het zoutzuur in de longen produceert..
Dat is de reden waarom elementair of gasvormig chloor niet veel toepassingen heeft, behalve in sommige syntheses. De verbindingen ervan, of het nu zouten of gechloreerde organische moleculen zijn, bestrijken een goed repertoire van toepassingen, verder dan zwembaden en extreem witte kleding..
Evenzo worden zijn atomen in de vorm van chloride-anionen in ons lichaam aangetroffen, die de niveaus van natrium, calcium en kalium reguleren, evenals in maagsap. Anders zou de inname van natriumchloride nog dodelijker zijn.
Chloor wordt geproduceerd door elektrolyse van pekel, rijk aan natriumchloride, een industrieel proces waarbij ook natriumhydroxide en waterstof worden verkregen. En omdat de zeeën een bijna onuitputtelijke bron van dit zout zijn, zijn de potentiële reserves van dit element in de hydrosfeer erg groot..
Artikel index
- 1 Geschiedenis
- 1.1 Eerste benaderingen
- 1.2 Ontdekking
- 1.3 Oxymuratisch zuur
- 1.4 Erkenning als element
- 2 Fysische en chemische eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Atoomnummer (Z)
- 2.3 Atoomgewicht
- 2.4 Kookpunt
- 2.5 Smeltpunt
- 2.6 Dichtheid
- 2.7 Warmte van fusie
- 2.8 Verdampingswarmte
- 2,9 Molaire warmtecapaciteit
- 2.10 Oplosbaarheid in water
- 2.11 Dampspanning
- 2.12 Elektronegativiteit
- 2.13 Ionisatie-energieën
- 2.14 Thermische geleidbaarheid
- 2.15 Isotopen
- 2.16 oxidatiegetallen
- 3 Structuur en elektronische configuratie
- 3.1 Chloormolecuul
- 3.2 Intermoleculaire interacties
- 4 Waar te vinden en te verkrijgen
- 4.1 Chloridezouten
- 4.2 Elektrolyse van pekel
- 4.3 Zure oplossing van pyrolusiet
- 5 legeringen
- 6 Risico's
- 7 toepassingen
- 7.1 Synthese
- 7.2 Biologicals
- 7.3 Chemische wapens
- 7.4 Desinfectiemiddel
- 7.5 Bleekmiddel
- 7.6 Polyvinylchloride
- 8 referenties
Verhaal
Eerste benaderingen
Vanwege de hoge reactiviteit van chloorgas, hebben oude beschavingen het bestaan ervan nooit vermoed. De verbindingen ervan maakten echter al sinds de oudheid deel uit van de cultuur van de mensheid; zijn geschiedenis begon verbonden met keukenzout.
Aan de andere kant ontstond chloor door vulkaanuitbarstingen en wanneer iemand goud oploste in aqua regia; Maar geen van die eerste benaderingen was zelfs genoeg om het idee te formuleren dat genoemd geelachtig groen gas een element of verbinding was.
Ontdekking
De ontdekking van chloor wordt toegeschreven aan de Zweedse chemicus Carl Wilhelm Scheele, die in 1774 de reactie uitvoerde tussen het mineraal pyrolusiet en zoutzuur (toen zoutzuur genoemd).
Scheele krijgt de eer omdat hij de eerste wetenschapper was die de eigenschappen van chloor bestudeerde; hoewel eerder erkend (1630) door Jan Baptist van Helmont.
De experimenten waarmee Scheele zijn waarnemingen heeft verkregen, zijn interessant: hij evalueerde de blekende werking van chloor op roodachtige en blauwachtige bloembladen van bloemen, evenals op de bladeren van planten en insecten die onmiddellijk stierven..
Evenzo meldde hij dat het sterk reactief is voor metalen, de verstikkende geur en het ongewenste effect op de longen, en dat wanneer het in water werd opgelost, de zuurgraad toenam..
Oxymuratisch zuur
Tegen die tijd beschouwden scheikundigen elke verbinding die zuurstof bevatte als een zuur; dus dachten ze ten onrechte dat chloor een gasvormig oxide moest zijn. Dat is hoe ze het 'oxymuraatzuur' (zoutzuuroxide) noemden, een naam bedacht door de beroemde Franse chemicus Antoine Lavoisier.
In 1809 probeerden Joseph Louis Gay-Lussac en Louis Jacques Thénard dit zuur met houtskool te verminderen; reactie waarmee ze metalen uit hun oxiden haalden. Op deze manier wilden ze het chemische element van het vermeende oxymuraatzuur (dat ze 'zoutzuur deflogsticated air' noemden) extraheren..
Gay-Lussac en Thénard faalden echter in hun experimenten; maar ze hadden gelijk toen ze de mogelijkheid in overweging namen dat genoemd geelachtig groen gas een chemisch element moet zijn en geen verbinding.
Erkenning als element
De erkenning van chloor als chemisch element was te danken aan Sir Humphry Davy, die in 1810 zijn eigen experimenten uitvoerde met koolstofelektroden en concludeerde dat een dergelijk oxide van zoutzuur niet bestond..
En bovendien was het Davy die de naam 'chloor' bedacht voor dit element van het Griekse woord 'chloros', wat geelachtig groen betekent..
Toen ze de chemische eigenschappen van chloor bestudeerden, bleken veel van de verbindingen ervan zout van aard te zijn; daarom noemden ze het een 'halogeen', wat zoutvormer betekent. Vervolgens werd de term halogeen gebruikt met de andere elementen van dezelfde groep (F, Br en I).
Michael Faraday slaagde er zelfs in om het chloor vloeibaar te maken tot een vaste stof die door vervuiling met water het hydraat Cl vormdetweeH.tweeOF.
De rest van de geschiedenis van chloor houdt verband met zijn desinfecterende en blekende eigenschappen, tot de ontwikkeling van het industriële proces van elektrolyse van pekel om enorme hoeveelheden chloor te produceren..
Fysische en chemische eigenschappen
Fysiek uiterlijk
Het is een dicht, ondoorzichtig, geelachtig groen gas met een irriterende bijtende geur (een sterk verbeterde versie van commercieel chloor) en is ook buitengewoon giftig..
Atoomnummer (Z)
17
Atoomgewicht
35.45 u.
Tenzij anders vermeld, komen alle andere eigenschappen overeen met de gemeten hoeveelheden voor moleculair chloor, Cltwee.
Kookpunt
-34,04 ºC
Smeltpunt
-101,5 ºC
Dichtheid
-Onder normale omstandigheden 3,2 g / L
-Precies op het kookpunt, 1,5624 g / ml
Merk op dat vloeibaar chloor ongeveer vijf keer zo dicht is als zijn gas. Ook is de dichtheid van de damp 2,49 keer groter dan die van lucht. Dat is de reden waarom chloor in de eerste afbeelding niet de neiging heeft om uit de ronde kolf te ontsnappen, omdat het dichter dan lucht is aan de onderkant. Deze eigenschap maakt het een nog gevaarlijker gas..
Warmte van fusie
6,406 kJ / mol
Warmte van verdamping
20,41 kJ / mol
Molaire warmtecapaciteit
33,95 J / (mol K)
Oplosbaarheid in water
1,46 g / 100 ml bij 0 ºC
Dampdruk
7,67 atm bij 25 ° C. Deze druk is relatief laag in vergelijking met andere gassen.
Elektronegativiteit
3.16 op de schaal van Pauling.
Ionisatie-energieën
-Ten eerste: 1251,2 kJ / mol
-Ten tweede: 2298 kJ / mol
-Ten derde: 3822 kJ / mol
Warmtegeleiding
8,9 10-3 W / (mK)
Isotopen
Chloor komt in de natuur voornamelijk voor als twee isotopen: 35Cl, met een overvloed van 76%, en 37Cl, met een overvloed van 24%. Het atoomgewicht (35,45 u) is dus een gemiddelde van de atoommassa's van deze twee isotopen, met hun respectievelijke abundantie-percentages..
Alle radio-isotopen van chloor zijn kunstmatig, waaronder de 36Cl als de meest stabiele, met een halfwaardetijd van 300.000 jaar.
Oxidatienummers
Chloor kan verschillende oxidatienummers of -toestanden hebben als het deel uitmaakt van een verbinding. Omdat het een van de meest elektronegatieve atomen in het periodiek systeem is, heeft het gewoonlijk negatieve oxidatiegetallen; behalve wanneer het zuurstof of fluor tegenkomt, in wiens oxiden respectievelijk fluoriden het elektronen moet "verliezen".
In hun oxidatiegetallen wordt het bestaan of de aanwezigheid van ionen met dezelfde grootte van lading verondersteld. We hebben dus: -1 (Cl-, het beroemde chloride-anion), +1 (Cl+), +2 (Cltwee+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) en +7 (Cl7+Van alle zijn -1, +1, +3, +5 en +7 de meest voorkomende in gechloreerde verbindingen..
Bijvoorbeeld in ClF en ClF3 de oxidatiegetallen voor chloor zijn +1 (Cl+F.-) en +3 (Cl3+F.3-In de CltweeOf dit is +1 (Cltwee+OFtwee-terwijl in de ClOtwee, CltweeOF3 en CltweeOF7, zijn +4 (Cl4+OFtweetwee-), +3 (Cltwee3+OF3twee-) en +7 (Cltwee7+OF7twee-.
In alle chloriden daarentegen heeft chloor een oxidatiegetal van -1; zoals in het geval van NaCl (Na+Cl-), waar het geldig is om te zeggen dat de Cl bestaat- gezien de ionische aard van dit zout.
Structuur en elektronische configuratie
Chloor molecuul

Chlooratomen in hun grondtoestand hebben de volgende elektronische configuratie:
[Ne] 3stwee 3p5
Daarom heeft elk van hen zeven valentie-elektronen. Tenzij ze overladen zijn met energie, zullen er individuele Cl-atomen in de ruimte zijn, zoals groene knikkers. Hun natuurlijke neiging is echter om covalente bindingen tussen hen te vormen om hun valentie-octetten te voltooien..
Merk op dat ze nauwelijks één elektron nodig hebben om acht valentie-elektronen te hebben, dus vormen ze een enkele eenvoudige binding; dit is degene die twee Cl-atomen verbindt om het Cl-molecuul te creërentwee (bovenste afbeelding), Cl-Cl. Daarom is chloor in normale en / of terrestrische omstandigheden een moleculair gas; niet mono-atomair, zoals bij edelgassen.
Intermoleculaire interacties
Het Cl-molecuultwee het is homonucleair en apolair, dus zijn intermoleculaire interacties worden beheerst door de Londense verstrooiingskrachten en zijn moleculaire massa's. In de gasfase is de afstand Cltwee-Cltwee het is relatief kort in vergelijking met andere gassen, waardoor het, toegevoegd aan zijn massa, een gas wordt dat drie keer zo dicht is als lucht.
Licht kan elektronische overgangen binnen de moleculaire orbitalen van Cl opwekken en bevorderentweebijgevolg verschijnt zijn karakteristieke geelachtig groene kleur. Deze kleur wordt in vloeibare toestand intenser en verdwijnt vervolgens gedeeltelijk wanneer deze stolt.
Als de temperatuur daalt (-34 ºC), komen de Cl-moleculentwee kinetische energie en afstand verliezen Cltwee-Cltwee neemt af; daarom smelten deze samen en definiëren ze uiteindelijk het vloeibare chloor. Hetzelfde gebeurt als het systeem nog meer wordt gekoeld (-101 ºC), nu met de Cl-moleculentwee zo dicht bij elkaar dat ze een orthorhombisch kristal definiëren.
Het feit dat er chloorkristallen bestaan, is een aanwijzing dat hun dispergerende krachten voldoende gericht zijn om een structureel patroon te creëren; dat wil zeggen, moleculaire lagen van Cltwee. De scheiding van deze lagen is zodanig dat hun structuur niet verandert, zelfs niet onder een druk van 64 GPa, en ze vertonen ook geen elektrische geleiding..
Waar te vinden en te verkrijgen
Chloridezouten

Chloor in gasvormige toestand kan nergens op het aardoppervlak worden gevonden, omdat het zeer reactief is en de neiging heeft om chloriden te vormen. Deze chloriden zijn goed verspreid over de aardkorst en verrijken bovendien, na miljoenen jaren te zijn weggespoeld door de regen, de zeeën en oceanen..
Van alle chloriden is de NaCl van het mineraal haliet (bovenste afbeelding) de meest voorkomende en overvloedige; gevolgd door de mineralen silvin, KCl en carnalite, MgCltweeKCl 6HtweeO. Wanneer watermassa's onder invloed van de zon verdampen, laten ze woestijnzoutmeren achter, waaruit direct NaCl kan worden gewonnen als grondstof voor de productie van chloor..
Elektrolyse van pekel
Het NaCl lost op in water om een pekel (26%) te produceren, dat wordt onderworpen aan elektrolyse in een chloor-alkalicel. Daar vinden twee halfreacties plaats in de anode- en kathodecompartimenten:
2Cl-(ac) => Cltwee(g) + 2e- (Anode)
2HtweeO (l) + 2e- => 2OH-(ac) + Htwee(g) (Kathode)
En de globale vergelijking voor beide reacties is:
2NaCl (aq) + 2HtweeO (l) => 2NaOH (aq) + Htwee(g) + Cltwee(g)
Naarmate de reactie vordert, worden de Na-ionen+ gevormd bij de anode migreren in het kathodecompartiment door een permeabel asbestmembraan. Om deze reden staat NaOH aan de rechterkant van de globale vergelijking. Beide gassen, Cltwee en Htwee, worden verzameld van respectievelijk de anode en kathode.
De onderstaande afbeelding illustreert wat er zojuist is geschreven:
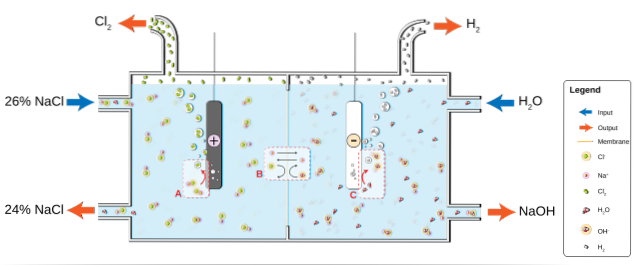
Merk op dat de concentratie van de pekel aan het einde met 2% afneemt (het gaat van 24 naar 26%), wat betekent dat een deel van zijn anionen Cl- originelen werden omgezet in Cl-moleculentwee. Uiteindelijk heeft de industrialisatie van dit proces een methode opgeleverd om chloor, waterstof en natriumhydroxide te produceren.
Zure oplossing van pyrolusiet
Zoals vermeld in de geschiedenissectie, kan chloorgas worden geproduceerd door pyrolusietmineraalmonsters op te lossen met zoutzuur. De volgende chemische vergelijking toont de producten die uit de reactie zijn verkregen:
MnOtwee(s) + 4HCl (aq) => MnCltwee(aq) + 2HtweeO (l) + Cltwee(g)
Legeringen
Chloorlegeringen bestaan niet om twee eenvoudige redenen: hun gasvormige moleculen kunnen niet worden opgesloten tussen metallische kristallen, en ze zijn ook erg reactief, dus ze zouden onmiddellijk reageren met metalen om hun respectievelijke chloriden te produceren..
Anderzijds zijn chloriden ook niet wenselijk, aangezien ze, eenmaal opgelost in water, een zouteffect hebben dat corrosie in legeringen bevordert; en daarom lossen metalen op om metaalchloriden te vormen. Het corrosieproces voor elke legering is anders; sommige zijn gevoeliger dan andere.
Chloor is daarom helemaal geen goed additief voor legeringen; noch als Cltwee noch als Cl- (en Cl-atomen zouden erg reactief zijn, dus ze kunnen zelfs bestaan).
Risico's
Hoewel de oplosbaarheid van chloor in water laag is, is het voldoende om zoutzuur te produceren in het vocht van onze huid en ogen, waardoor de weefsels gaan corroderen en ernstige irritatie en zelfs verlies van het gezichtsvermogen kunnen veroorzaken..
Nog erger is het inademen van de groenachtig gele dampen, aangezien het eenmaal in de longen weer zuren genereert en het longweefsel beschadigt. Hiermee ervaart de persoon keelpijn, hoesten en ademhalingsmoeilijkheden als gevolg van het vocht dat in de longen wordt gevormd.
Als er een chloorlek is, bevindt u zich in een bijzonder gevaarlijke situatie: de lucht kan zijn dampen niet zomaar "wegvegen"; ze blijven daar totdat ze reageren of langzaam verdwijnen.
Daarnaast is het een sterk oxiderende verbinding, zodat verschillende stoffen er bij het minste contact explosief mee kunnen reageren; net als staalwol en aluminium. Daarom moeten bij opslag van chloor alle nodige overwegingen worden genomen om brandgevaar te vermijden..
Ironisch genoeg is chloorgas dodelijk, maar het chloride-anion ervan is niet giftig; Het kan (met mate) worden geconsumeerd, het brandt niet en reageert ook niet behalve met fluor en andere reagentia.
Toepassingen
Synthese
Ongeveer 81% van het jaarlijks geproduceerde chloorgas wordt gebruikt voor de synthese van organische en anorganische chloriden. Afhankelijk van de mate van covalentie van deze verbindingen, kan chloor worden gevonden als louter Cl-atomen in gechloreerde organische moleculen (met C-Cl-bindingen), of als Cl-ionen- in een paar chloridezouten (NaCl, CaCltwee, MgCltwee, enz.).
Elk van deze verbindingen heeft zijn eigen toepassingen. Bijvoorbeeld chloroform (CHCl3) en ethylchloride (CH3CHtweeCl) zijn oplosmiddelen die worden gebruikt als inhalatie-anesthetica; dichloormethaan (CHtweeCltwee) en tetrachloorkoolstof (CCl4) zijn oplosmiddelen die veel worden gebruikt in laboratoria voor organische chemie.
Wanneer deze gechloreerde verbindingen vloeibaar zijn, worden ze meestal gebruikt als oplosmiddelen voor organische reactiemedia..
In andere verbindingen vertegenwoordigt de aanwezigheid van chlooratomen een toename van het dipoolmoment, zodat ze in grotere mate kunnen interageren met een polaire matrix; een die bestaat uit eiwitten, aminozuren, nucleïnezuren, enz., biomoleculen. Chloor speelt dus ook een rol bij de synthese van medicijnen, pesticiden, insecticiden, fungiciden, enz..
Anorganische chloriden worden meestal gebruikt als katalysatoren, grondstof voor het verkrijgen van metalen door elektrolyse, of bronnen van Cl-ionen.-.
Biologisch
Het gasvormige of elementaire chloor speelt binnen levende wezens geen andere rol dan het vernietigen van hun weefsels. Dit betekent echter niet dat de atomen ervan niet in het lichaam kunnen worden gevonden. Bijvoorbeeld Cl-ionen- zijn zeer overvloedig aanwezig in de cellulaire en extracellulaire omgeving en helpen de niveaus van Na-ionen onder controle te houden+ en Catwee+, meestal.
Evenzo maakt zoutzuur deel uit van het maagsap waarmee voedsel in de maag wordt verteerd; zijn Cl-ionen-, in het gezelschap van H3OF+, definieer de pH dicht bij 1 van deze afscheidingen.
Chemische wapens
De dichtheid van chloorgas maakt het een dodelijke stof wanneer het wordt gemorst of in gesloten of open ruimtes wordt gegoten. Omdat het dichter is dan lucht, kan een stroom ervan niet gemakkelijk chloor vervoeren, dus het blijft geruime tijd aanwezig voordat het zich uiteindelijk verspreidt.
In de Eerste Wereldoorlog werd dit chloor bijvoorbeeld gebruikt op slagvelden. Eenmaal vrijgelaten, sloop hij de loopgraven in om de soldaten te verstikken en ze naar de oppervlakte te dwingen..
Ontsmettingsmiddel

Gechloreerde oplossingen, die waarbij chloorgas is opgelost in water en vervolgens alkalisch is gemaakt met een buffer, hebben uitstekende desinfecterende eigenschappen en remmen weefselverrotting. Ze zijn gebruikt om open wonden te desinfecteren om pathogene bacteriën te elimineren.
Zwembadwater wordt nauwkeurig gechloreerd om bacteriën, microben en parasieten die zich erin kunnen nestelen, te elimineren. Voor dit doel werd vroeger chloorgas gebruikt, maar de werking is behoorlijk agressief. In plaats daarvan worden natriumhypochlorietoplossingen (bleekmiddel) of trichloorisocyanuurzuur (TCA) -tabletten gebruikt..
Uit het bovenstaande blijkt dat het niet de Cl istwee degene die de desinfecterende werking uitoefent, maar HClO, hypochlorietzuur, dat O-radicalen produceert die micro-organismen vernietigen.
Bleken
Zeer vergelijkbaar met zijn desinfecterende werking, bleek chloor ook materialen omdat de kleurstoffen die verantwoordelijk zijn voor de kleuren worden afgebroken door HClO. De gechloreerde oplossingen zijn dus ideaal voor het verwijderen van vlekken uit witte kledingstukken of voor het bleken van papierpulp..
Polyvinylchloride
De belangrijkste chloorverbinding van allemaal, die goed is voor ongeveer 19% van de resterende chloorgasproductie, is polyvinylchloride (PVC). Dit plastic heeft meerdere toepassingen. Hiermee worden waterleidingen, raamkozijnen, wand- en vloerbedekkingen, elektrische bedrading, infuuszakken, jassen etc. gemaakt..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Chloor. Hersteld van: en.wikipedia.org
- Laura H. et al. (2018). Structuur van vast chloor op 1,45 GPaZeitschrift für Kristallographie. Crystalline Materials, Volume 234, Issue 4, Pages 277-280, ISSN (Online) 2196-7105, ISSN (Print) 2194-4946, DOI: doi.org/10.1515/zkri-2018-2145
- Nationaal centrum voor informatie over biotechnologie. (2019). Chloor. PubChem-database. CID = 24526. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Markies Miguel. (s.f.). Chloor. Hersteld van: nautilus.fis.uc.pt
- American Chemistry Council. (2019). Chloorchemie: inleiding tot chloor. Hersteld van: chloor.americanchemistry.com
- Fong-Yuan Ma. (S.f.). Corrosieve effecten van chloriden op metalen. Afdeling Marine Engineering, NTOU Republiek China (Taiwan).
- New York staat. (2019). De feiten over chloor. Hersteld van: health.ny.gov
- Dr. Doug Stewart. (2019). Feiten over chloorelementen. Chemicool. Hersteld van: chemicool.com

Niemand heeft nog op dit artikel gereageerd.