
Formule, eigenschappen, toepassingen en risico's van bariumchloride (BaCl2)
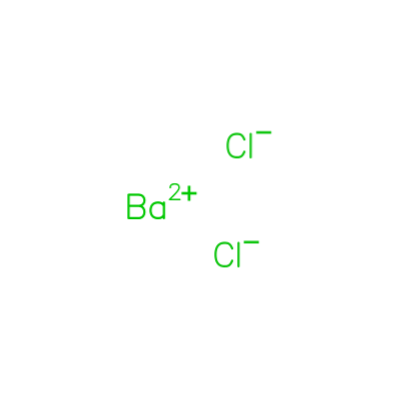
De Bariumchloride is een chemische verbinding met formule BaCltwee Het bestaat in watervrije en in dihydraatvorm. Het bestaat uit kleurloze kristallen die oplosbaar zijn in water, het wordt gebruikt in warmtebehandelingsbaden en in laboratoria als een chemisch reagens om oplosbare sulfaten neer te slaan.
Bariumchloride is een van de meest in water oplosbare bariumzouten. Net als andere bariumzouten is het giftig en geeft het een geelgroene kleur aan een vlam. Het is ook hygroscopisch.
Er zijn verschillende methoden om bariumchloride te produceren, een daarvan is door de werking van zoutzuur op bariumcarbonaat:
2HCl + BaCO3 → BaCltwee +COtwee +H.tweeOF
Een andere methode om bariumchloride te produceren is door een mengsel van bariumsulfaat, koolstof en bariumchloride te verhitten..
Baso4(s) + 4C (s) → BaS (s) + 4CO (g)
BaS (s) + CaCltwee → BaCltwee + CaS
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen
Bariumchloride zijn kristallen, orthorhombisch in hun watervrije vorm en monoklien in hun dihydraatvorm, wit van kleur zonder een karakteristiek aroma (National Center for Biotechnology Information., 2005). Het uiterlijk wordt getoond in figuur 2.

De verbinding heeft een molecuulgewicht van 208,23 g / mol voor zijn watervrije vorm en 244,26 voor zijn dihydraatvorm..
Het heeft een dichtheid van 3,856 g / ml voor de watervrije vorm en 3,098 g / ml voor de dihydraatvorm. Het smelt- en kookpunt is respectievelijk 963 ° C en 1560 ° C..
Bariumchloride is zeer oplosbaar in water en kan 35,8 gram verbinding oplossen in 100 ml oplosmiddel. Kan heftig reageren met BrF3 en 2-furaan-percarbonzuur in zijn watervrije vorm.
Reactiviteit en gevaren
Bariumchloride is buitengewoon giftig en giftig. Het inslikken veroorzaakt orgaanschade. Bariumchloride blokkeert kaliumkanalen omdat het een middel is dat de glycoproteïnen van het celmembraan remt die selectief doorlaatbaar zijn voor kaliumionen..
Het veroorzaakt ook ernstig oogletsel. Het is niet brandbaar en reageert niet met andere chemicaliën.
Controleer in geval van contact met de ogen of u contactlenzen draagt en verwijder deze onmiddellijk. Ogen moeten gedurende minstens 15 minuten met stromend water worden gespoeld, waarbij de oogleden open moeten blijven. Koud water kan worden gebruikt. Oogzalf mag niet worden gebruikt.
Als de chemische stof in contact komt met kleding, moet u deze zo snel mogelijk verwijderen en daarbij uw eigen handen en lichaam beschermen.
Plaats het slachtoffer onder een veiligheidsdouche. Als de chemische stof zich ophoopt op de blootgestelde huid van het slachtoffer, zoals de handen, wordt de besmette huid voorzichtig en voorzichtig gewassen met stromend water en niet-schurende zeep..
Koud water kan worden gebruikt. Roep medische hulp in als de irritatie aanhoudt. Was de besmette kleding voordat u deze opnieuw gebruikt.
Als het contact met de huid ernstig is, moet deze worden gewassen met een desinfecterende zeep en de besmette huid bedekken met een antibacteriële crème..
Bij inademing moet het slachtoffer rusten in een goed geventileerde ruimte. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilige plaats worden geëvacueerd..
Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas. Als het slachtoffer moeite heeft met ademen, moet zuurstof worden toegediend. Als het slachtoffer niet ademt, wordt mond-op-mondbeademing uitgevoerd.
Houd er altijd rekening mee dat het gevaarlijk kan zijn voor de persoon die hulp verleent om mond-op-mondbeademing te geven wanneer het ingeademde materiaal giftig, besmettelijk of bijtend is..
Bij inslikken mag braken alleen worden opgewekt als het slachtoffer bij bewustzijn is. Strakke kleding, zoals kragen, riemen of stropdassen, moet worden losgemaakt. Als het slachtoffer niet ademt, voer dan mond-op-mondbeademing uit.
Zoek in alle gevallen onmiddellijk medische hulp..
Bariumchloride is een schadelijke stof voor het milieu, vooral voor in het water levende soorten, dus het moet worden behandeld en verwijderd volgens de vastgestelde regels en voorschriften..
Toepassingen
Bariumchloridedihydraat wordt gebruikt bij de behandeling van afvalwater, de productie van PVC-stabilisatoren, oliesmeermiddelen, bariumchromaat en bariumfluoride.
Als goedkoop en oplosbaar bariumzout vindt bariumchloride een brede toepassing in het laboratorium. Het wordt vaak gebruikt als een test voor sulfaationen.
In de industrie wordt bariumchloride voornamelijk gebruikt bij de zuivering van de pekeloplossing in bijtende chloorfabrieken en ook bij de productie van warmtebehandelingszouten, staalharding, pigmentproductie en bij de productie van andere zouten van barium..
Het wordt ook gebruikt bij vuurwerk om een felgroene kleur te geven. De toxiciteit ervan beperkt echter de toepasbaarheid.
Bariumchloride werd voorheen in de geneeskunde gebruikt om een volledig hartblok te behandelen. De gebruikelijke dosis was 30 mg drie- of viermaal daags of ongeveer 1,7 mg / kg / dag..
Het gebruik van het medicijn werd stopgezet, grotendeels vanwege de toxiciteit ervan. Het werd vroeger gebruikt voor de symptomatische therapie van aanvallen van Stokes-Adams. Nu is deze behandeling achterhaald. De radioactieve verbinding wordt gebruikt als een experimenteel botscanmiddel.
In de diergeneeskunde wordt bariumchloride gebruikt bij de behandeling van impactie bij paarden. De intraveneuze injectie van 0,5 g zorgt voor een drastische zuivering. Het gebruik ervan wordt niet aanbevolen vanwege een groot risico op het veroorzaken van een fatale hartblokkade.
Referenties
- (2016). BARIUMCHLORIDE. Ontleend aan cameochemicaliën: cameochemicals.noaa.gov.
- EMBL-EBI. (2015, 24 juni). bariumchloride. Ontleend aan ChEBI: ebi.ac.uk.
- Hanusa, T. P. (2017, 22 februari). Barium (Ba). Ontleend aan britannica: britannica.com.
- Veiligheidsinformatieblad Bariumchloride-dihydraat. (2013, 21 mei). Ontleend aan sciencelab: sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie. (2005, 26 maart). PubChem samengestelde database; CID = 25204. Overgenomen uit PubChem: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Bariumchloride. Ontleend aan chemspider: chemspider.com.
- (S.F.). Bariumchloride. Overgenomen van solvay: solvay.com.
- Het National Institute for Occupational Safety and Health (NIOSH). (2015, 22 juli). BARIUMCHLORIDE. Genomen uit cdc.gov: cdc.gov.
- S. National Library of Medicine. (2012, 3 mei). BARIUMCHLORIDE. Genomen uit toxnet: toxnet.nlm.nih.gov.


Niemand heeft nog op dit artikel gereageerd.