
Lithiumchloride (LiCl) eigenschappen, risico's en toepassingen
De Lithiumchloride Het is een chemische verbinding met de formule LiCl die kan worden gemaakt door lithium en chloor te ontsteken, hoewel het moeilijk is omdat de reactie heftig is. Op deze manier wordt de watervrije vorm (zonder water) geproduceerd. Lithiumchloride kan ook worden geëxtraheerd uit andere alkalimetaalchloriden met amylalcohol..
Tot de jaren negentig werd de metaal- en lithiummarkt gedomineerd door de Amerikaanse productie uit minerale afzettingen. Aan het begin van de 21e eeuw was de meeste productie echter afkomstig van niet-Amerikaanse bronnen, waarbij Australië, Chili en Portugal de belangrijkste leveranciers ter wereld waren..
Als curiositeit is het vermeldenswaard dat, hoewel Bolivia de helft van alle lithiumafzettingen ter wereld heeft, het geen grote producent is.
De belangrijkste commerciële vorm is lithiumcarbonaat, LitweeCO3, geproduceerd uit mineralen of pekel door verschillende processen.
Door toevoeging van zoutzuur (HCl) ontstaat lithiumchloride. Met deze methode wordt de gehydrateerde verbinding (water gebonden aan het molecuul) geproduceerd. De gehydrateerde vorm kan worden gedroogd tot de watervrije vorm door deze te verwarmen met waterstofchloridegas..
Fysische en chemische eigenschappen van lithiumchloride
Lithiumchloride is een witte vaste stof zonder specifiek aroma en een zoute smaak (National Center for Biotechnology Information, 2005). Het uiterlijk wordt getoond in figuur 2.

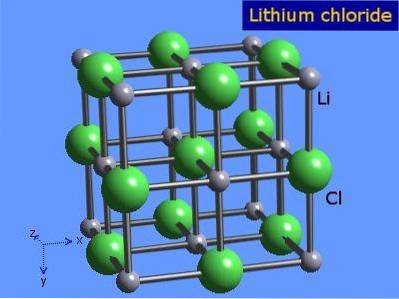
Lithiumchloride zijn zeer hygroscopische kristallen met een octaëdrische geometrie die vergelijkbaar is met die van natriumchloride. De kristallijne structuur wordt weergegeven in figuur 3 (Winter, S.F.).
Het molecuulgewicht is 42,39 g / mol, de dichtheid is 2,068 g / ml en het smelt- en kookpunt is respectievelijk 605 ºC en 1360 ºC..
De verbinding is zeer oplosbaar in water, alcohol, ether, pyridine en nitrobenzeen (Royal Society of Chemistry, 2015).
Lithiumchloride heeft een zwak oxiderende of reducerende vermogen. Redoxreacties kunnen echter nog steeds optreden. Lithiumchloride-oplossingen zijn in het algemeen noch sterk zuur noch sterk basisch..
Omdat het extreem hygroscopisch is, kan lithiumchloride ook tot vier equivalenten ammoniak per mol absorberen. Waterige lithiumchlorideoplossingen kunnen metalen aantasten (LITHIUM CHLORIDE, S.F.).
Reactiviteit en gevaren
Lithiumchloride is een stabiele verbinding die niet compatibel is met sterke oxidatiemiddelen, sterke zuren, broomtrichloride, broomtrifluoride.
Het is niet giftig bij inslikken, maar vanwege zijn corrosieve aard kan het irriterend zijn bij contact met de huid en ogen, het kan ook de neusgangen irriteren (National Institute for Occupational Safety and Health, 2015).
Controleer in geval van contact met de ogen of u contactlenzen draagt en verwijder deze onmiddellijk..
Ogen moeten gedurende minstens 15 minuten met stromend water worden gespoeld, waarbij de oogleden open moeten blijven. Koud water kan worden gebruikt. Oogzalf mag niet worden gebruikt.
Als de chemische stof in contact komt met kleding, moet u deze zo snel mogelijk verwijderen en daarbij uw eigen handen en lichaam beschermen.
Plaats het slachtoffer onder een veiligheidsdouche. Als de chemische stof zich ophoopt op de blootgestelde huid van het slachtoffer, zoals de handen, wordt de besmette huid voorzichtig en voorzichtig gewassen met stromend water en niet-schurende zeep..
Koud water kan worden gebruikt. Roep medische hulp in als de irritatie aanhoudt. Was de besmette kleding voordat u deze opnieuw gebruikt.
Bij inademing moet het slachtoffer rusten in een goed geventileerde ruimte. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilige plaats worden geëvacueerd..
Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas. Als het slachtoffer moeite heeft met ademen, moet zuurstof worden toegediend.
Als het slachtoffer niet ademt, wordt mond-op-mondbeademing uitgevoerd. Houd er altijd rekening mee dat het gevaarlijk kan zijn voor de persoon die hulp verleent om mond-op-mondbeademing te geven wanneer het ingeademde materiaal giftig, besmettelijk of bijtend is..
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (Material Safety Data Sheet Lithiumchloride, 2013).
Toepassingen
Lithiumchloride is de verbinding die wordt gebruikt om lithiummetaal te produceren door middel van elektrolyse. Lithiummetaal wordt geproduceerd door elektrolyse van een gesmolten mengsel van lithium- en kaliumchloriden.
Het lagere smeltpunt van het mengsel (400-420 ° C of 750-790 ° F) vergeleken met dat van zuiver lithiumchloride (610 ° C of 1130 ° F) maakt het mogelijk om bij een lagere elektrolyse-temperatuur te werken.
Omdat de spanning waarbij de afbraak van lithiumchloride plaatsvindt lager is dan die van kaliumchloride, wordt lithium afgezet met een zuiverheid van meer dan 97 procent (Dye, 2017).
Vloeibaar lithiumchloride dient als een droogmiddel dat de luchtvochtigheid in de omringende lucht met wel 15 procent kan verlagen.
Vloeibare droogmiddelen die lithiumchloride en calciumchloride combineren, creëren een stof die goedkoper is dan lithiumchloride, maar stabieler dan calciumchloride..
Lithiumchloride koelt de lucht snel af omdat de chemische stof vanwege zijn gewicht als vaste stof een enorme hoeveelheid water bevat. De stof droogt ook grote hoeveelheden industriële gassen.
Lithiumchloride is een rode kleurstof in pyrotechnische voorstellingen zoals vuurwerk. Lithiumchloride, of een in water oplosbaar zout op lithiumbasis, brandt rood wanneer deze wordt ingeschakeld.
Speciale pyrotechnische effecten kunnen worden ontstoken door ionische zouten te mengen met brandbare vloeistoffen zoals methylalcohol..
In de jaren veertig van de vorige eeuw diende lithiumchloride als vervanging voor keukenzout, maar sommige patiënten stierven door giftige hoeveelheden lithium..
De verbinding heeft farmacologische toepassingen als antimaniacs, die middelen zijn die worden gebruikt voor het behandelen van bipolaire stoornissen of manie geassocieerd met andere affectieve stoornissen..
Het menselijk lichaam bevat normaal gesproken ongeveer 7 milligram lithium per keer..
Lithium komt van nature voor in planten, aangezien organismen de stof gebruiken om de groei te stimuleren.
Referenties
- Dye, J. L. (2017, 23 januari). Lithium (Li). Opgehaald van britannica: britannica.com.
- EMBL-EBI. (2009, 23 november). lithiumchloride. Opgehaald van ChEBI: ebi.ac.uk.
- LITHIUMCHLORIDE. (S.F.). Opgehaald van CAMEO: cameochemicals.noaa.gov.
- Veiligheidsinformatieblad Lithiumchloride. (2013, 21 mei). Opgehaald van sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie ... (2005, 26 maart). PubChem samengestelde database; CID = 433294. Opgehaald van PubChem.
- Nationaal instituut voor veiligheid en gezondheid op het werk. (2015, 22 juli). LITHIUMCHLORIDE. Hersteld van cdc.gov.
- Winter, M. (S.F.). Lithium: lithiumchloride. Hersteld van webelementen.

Niemand heeft nog op dit artikel gereageerd.