
Ferrochloride (FeCl2) Structuur, toepassingen, eigenschappen

De ijzer (II) chloride is een anorganische vaste stof gevormd door de vereniging van een Fe-kationtwee+ en twee chloride-anionen Cl-. De chemische formule is FeCltwee. Het heeft de neiging om water uit de omgeving op te nemen. Een van de hydraten is FeCl-tetrahydraattwee•4HtweeOf wat een groenachtige vaste stof is.
Opgemerkt moet worden dat het zeer oplosbaar is in water en de neiging heeft gemakkelijk te oxideren in aanwezigheid van lucht, waarbij ferrichloride FeCl wordt gevormd.3. Omdat het gemakkelijk oxideerbaar is en daarom in staat is als reductiemiddel te werken, wordt het veel gebruikt in chemische en biologische onderzoekslaboratoria..

Ferrochloride heeft verschillende toepassingen, waarvan de belangrijkste is om andere middelen te helpen bij de oxidatie van slib afkomstig van afvalwater of rioolwaterzuivering. Het wordt ook gebruikt in het ijzercoatingproces van metalen en heeft enkele toepassingen in de farmaceutische industrie..
Er is ook geëxperimenteerd met het gebruik van FeCltwee bij het terugwinnen van waardevolle metalen uit afgewerkte katalysatoren in de uitlaatpijpen van voertuigen die op benzine of diesel rijden.
Het wordt in de textielindustrie gebruikt om de kleuren in sommige soorten stof te fixeren.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Soortelijk gewicht
- 3.6 Oplosbaarheid
- 3.7 Overige eigendommen
- 4 Verkrijgen
- 5 toepassingen
- 5.1 Bij het kleuren van stoffen
- 5.2 Bij afvalwaterbehandeling
- 5.3 In chemische studies
- 5.4 In biochemische studies
- 6 referenties
Structuur
Ferrochloride bestaat uit een ferro-ion Fetwee+ en twee chloride-ionen Cl- verbonden door ionische bindingen.
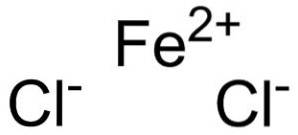
Ferro-ion Fetwee+ heeft de volgende elektronische structuur:
1stwee, 2 sectwee 2 Blz6, 3stwee 3p6 3d6, 4s0
waar te zien is dat hij twee elektronen verloor uit de 4s-schaal.
Deze configuratie is niet erg stabiel, en om deze reden heeft het de neiging te oxideren, dat wil zeggen, een ander elektron te verliezen, dit keer uit de 3d-laag, waardoor het Fe-ion wordt gevormd.3+.
Het chloride-ion Cl- heeft de volgende elektronische structuur:
1stwee, 2 sectwee 2 Blz6, 3stwee 3p6
waar je kunt zien dat het een extra elektron in de 3p-schaal heeft verworven, waarmee het is voltooid. Deze configuratie is erg stabiel omdat alle elektronische lagen compleet zijn.
Nomenclatuur
- Ferrochloride
- IJzer (II) chloride
- IJzerdichloride
- Ferrochloride Tetrahydraat: FeCltwee•4HtweeOF
Eigendommen
Fysieke toestand
Kleurloze tot lichtgroene vaste stof, kristallen.
Molecuulgewicht
126,75 g / mol
Smeltpunt
674 ºC
Kookpunt
1023 ºC
Specifiek gewicht
3.16 bij 25 ºC / 4 ºC
Oplosbaarheid
Zeer oplosbaar in water: 62,5 g / 100 ml bij 20 ºC. Oplosbaar in alcohol, aceton. Enigszins oplosbaar in benzeen. Vrijwel onoplosbaar in ether.
Andere eigenschappen
FeCltwee watervrij is erg hygroscopisch. Het absorbeert gemakkelijk water uit de omgeving en vormt een verscheidenheid aan hydraten, vooral het tetrahydraat, waarin voor elk FeCl-molecuultwee er zijn 4 moleculen van H.tweeOf hieraan vastgemaakt (FeCltwee•4HtweeOF).
In aanwezigheid van lucht oxideert het langzaam tot FeCl3. Dit betekent dat het Fe-iontwee+ gemakkelijk geoxideerd tot Fe-ion3+.
Bij verhitting in aanwezigheid van lucht wordt snel ijzerchloride FeCl gevormd3 en ijzeroxide FetweeOF3.
FeCltwee het is bijtend voor metalen en weefsels.
Het verkrijgen van
Het wordt verkregen door een overmaat ijzermetaal Fe te behandelen met een waterige oplossing van zoutzuur HCl bij hoge temperaturen..
Geloof0 + 2 HCl → FeCltwee + 2 uur+
Door de aanwezigheid van water bij deze methode wordt echter het ferrochloridetetrahydraat FeCl verkregen.twee•4HtweeOF.
Om het watervrij te verkrijgen (zonder dat er water in de kristallen zit), hebben sommige onderzoekers ervoor gekozen om de reactie uit te voeren van ijzerpoeder met watervrij HCl (zonder water) in het oplosmiddel tetrahydrofuraan (THF) bij een temperatuur van 5 ºC..
Op deze manier wordt de verbinding FeCl verkregentwee•1,5THF, dat bij verhitting tot 80-85 ºC onder vacuüm of in een stikstofatmosfeer (om de aanwezigheid van water te vermijden) FeCl produceerttwee watervrij.
Toepassingen
Ferrochloride heeft verschillende toepassingen, meestal gebaseerd op zijn reducerend vermogen, dat wil zeggen dat het gemakkelijk kan worden geoxideerd. Het wordt bijvoorbeeld gebruikt in verven en coatings, omdat het helpt om ze aan het oppervlak te bevestigen.
IJzer is een essentiële micronutriënt voor de gezondheid van mens en dier. Het is betrokken bij de synthese van eiwitten, bij de ademhaling en bij de vermenigvuldiging van cellen.
Vandaar de FeCltwee het wordt gebruikt in farmaceutische preparaten. Het Fe-iontwee+ als zodanig wordt het beter geabsorbeerd dan het Fe-ion3+ in de darmen.
Het wordt gebruikt voor de vervaardiging van FeCl3. Het wordt gebruikt in de metallurgie, in ijzeren bekledingsbaden, om een meer ductiele afzetting te verkrijgen.
Hier zijn andere aanbevolen toepassingen.
Bij het inkleuren van stoffen
FeCltwee Het wordt in sommige soorten stof gebruikt als bijt- of kleurstoffixeermiddel. De bijtende stof reageert chemisch en bindt gelijktijdig aan de kleurstof en de stof, waardoor er een onoplosbare verbinding op wordt gevormd..
Op deze manier blijft de kleurstof aan de stof vastzitten en wordt de kleur intenser..
Bij afvalwaterzuivering
FeCltwee gebruikt in riool- of afvalwaterzuiveringsinstallaties (afvalwater).
In deze toepassing neemt ferrochloride deel aan de oxidatie van het slib, via een proces dat Fenton-oxidatie wordt genoemd. Deze oxidatie zorgt voor de afbraak van de slibvlokken en laat het water vrij dat er sterk aan gebonden is..

Het slib kan vervolgens worden gedroogd en op een milieuvriendelijke manier worden afgevoerd. Het gebruik van ferrochloride helpt om de kosten van het proces te verlagen.
Recent is ook voorgesteld het te gebruiken om de vorming van waterstofsulfide of waterstofsulfide in dit rioolwater te verminderen..
Op deze manier zou de corrosie die door dit gas wordt geproduceerd en ook onaangename geuren worden verminderd..
In chemische studies
Vanwege zijn reducerende eigenschappen (het tegenovergestelde van oxidatiemiddel), FeCltwee Het wordt veel gebruikt in verschillende onderzoeken in scheikunde, natuurkunde en technische laboratoria.
Bepaalde wetenschappers gebruikten ferrochloridedampen om waardevolle metalen zoals platina, palladium en rhodium te extraheren uit gebruikte katalysatoren in benzine- of dieselvoertuigen..
Deze katalysatoren worden gebruikt om gassen te verwijderen die schadelijk zijn voor mens en milieu. Ze bevinden zich in de uitlaatpijp van auto's en vrachtwagens die op benzine of diesel rijden.

Na een bepaalde tijd verslijt de katalysator van het voertuig en verliest deze zijn effectiviteit en moet deze worden vervangen. De gebruikte katalysator wordt weggegooid en er wordt gewerkt aan het terugwinnen van de waardevolle metalen die erin zitten..

Volgens de onderzoekers vormden deze metalen magnetische legeringen met het ijzer in ferrochloride..
De legeringen konden worden geëxtraheerd met magneten en vervolgens konden de waardevolle metalen worden teruggewonnen met bekende methoden..
In biochemische studies
Voor het bezitten van het Fe-kationtwee+, dat is een belangrijke micronutriënt bij mensen en sommige dieren, FeCltwee gebruikt in biochemie en geneeskunde studies.
Bepaalde onderzoeken hebben aangetoond dat ferrochloride de fungicide werkzaamheid van koud argonplasma verbetert..
Koud plasma is een technologie die wordt gebruikt voor de sterilisatie van medische oppervlakken en instrumenten. Het is gebaseerd op de vorming van hydroxylradicalen OH · uit de vochtigheid van de omgeving. Deze radicalen reageren met de celwand van het micro-organisme en veroorzaken de dood ervan.
In dit onderzoek is de FeCltwee verbeterde het effect van koud plasma en versnelde de eliminatie van een schimmel die resistent was tegen andere desinfectiemethoden.
Sommige wetenschappers ontdekten dat het gebruik van FeCltwee laat toe om de opbrengst van de reacties te verhogen om glucose te verkrijgen uitgaande van suikerriet bagasse.
In dit geval de Fetwee+ een essentieel micro-element voor de menselijke gezondheid, zijn aanwezigheid in sporen in het product zou geen invloed hebben op de mens.
Referenties
- Fukuda, S. et al. (2019). Ferrochloride en ferrosulfaat verbeteren de fungicide werkzaamheid van koud atmosferisch argonplasma op gemelaniseerde Aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28-32. Opgehaald van ncbi.clm.nih.gov.
- Ismal, O.E. en Yildirim, L. (2019). Metaalbeitsmiddelen en biomordanten. In de impact en vooruitzichten van groene chemie voor textieltechnologie. Hoofdstuk 3, pp.57-82. Opgehaald van sciencedirect.com.
- Zhang, W. et al. (2019). Co-katalyse van magnesiumchloride en ferrochloride voor xylo-oligosacchariden en glucoseproductie uit suikerrietbagasse. Bioresour Technol 2019, 291: 121839. Opgehaald van ncbi.nlm.nih.gov.
- Zhou, X. et al. (2015). De rol van inheems ijzer bij het verbeteren van de ontwaterbaarheid van slib door middel van peroxidatie. Wetenschappelijke rapporten 5: 7516. Opgehaald van ncbi.nlm.nih.gov.
- Rathnayake, D. et al. (2019). Waterstofsulfidebeheersing in riolen door de reactie met zuurstof te katalyseren. Wetenschap van de totale omgeving 689 (2019) 1192-1200. Opgehaald van ncbi.nlm.nih.gov.
- Taninouchi, Y. en Okabe, T.H. (2018). Terugwinning van metalen uit de platinagroep uit gebruikte katalysatoren met behulp van ijzerchloride-dampbehandeling. Metall en Materi Trans B (2018) 49: 1781. Opgehaald van link.springer.com.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Ferrochloride. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. et al. (1977). IJzer (0) oxidatie door waterstofchloride in tetrahydrofuraan: een eenvoudige manier om watervrij ijzer (II) chloride te verkrijgen. Inorganic Chemistry, deel 16, nr. 7, 1977. Hersteld van pubs.acs.org.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.



Niemand heeft nog op dit artikel gereageerd.