
Expressie van chemische concentratie, eenheden, molaliteit

De chemische concentratie is de numerieke maat voor de relatieve hoeveelheid opgeloste stof in een oplossing. Deze maat drukt een verhouding uit van de opgeloste stof tot een hoeveelheid of volume van het oplosmiddel of de oplossing in concentratie-eenheden. De term 'concentratie' heeft betrekking op de hoeveelheid aanwezige opgeloste stof: een oplossing zal meer geconcentreerd zijn naarmate deze meer opgelost is.
Deze eenheden kunnen fysiek zijn wanneer rekening wordt gehouden met de massa en / of volumegroottes van de oplossing of chemische componenten, wanneer de concentratie van de opgeloste stof wordt uitgedrukt in termen van molen of equivalenten, waarbij het getal van Avogadro als referentie wordt genomen..

Door molecuul- of atoomgewichten en het getal van Avogadro te gebruiken, is het dus mogelijk om fysieke eenheden om te zetten in chemische eenheden wanneer de concentratie van een bepaalde opgeloste stof wordt uitgedrukt. Daarom kunnen alle units worden omgebouwd voor dezelfde oplossing.
Artikel index
- 1 Verdunde en geconcentreerde oplossingen
- 2 manieren om concentratie uit te drukken
- 2.1 Kwalitatieve beschrijving
- 2.2 Indeling naar oplosbaarheid
- 2.3 Kwantitatieve notatie
- 3 concentratie-eenheden
- 3.1 Relatieve concentratie-eenheden
- 3.2 Eenheden van verdunde concentratie
- 3.3 Eenheden van concentratie als functie van mollen
- 3.4 Formaliteit en normaliteit
- 4 Molariteit
- 4.1 Oefening 1
- 4.2 Oefening 2
- 5 Normaliteit
- 5.1 Berekening
- 5.2 Oefening 1
- 6 Molaliteit
- 6.1 Oefening 1
- 7 Belangrijke opmerkingen en aanbevelingen over chemische concentratie
- 7.1 Het volume van de oplossing is altijd groter dan dat van het oplosmiddel
- 7.2 Nut van molariteit
- 7.3 Formules worden niet onthouden, maar eenheden of definities wel
- 8 referenties
Verdunde en geconcentreerde oplossingen
Hoe weet je of een concentratie erg verdund of geconcentreerd is? Op het eerste gezicht door de manifestatie van een van zijn organoleptische of chemische eigenschappen; dat wil zeggen, degene die de zintuigen waarnemen of die kunnen worden gemeten.
De afbeelding hierboven toont een verdunning van een concentratie kaliumdichromaat (KtweeCrtweeOF7), die een oranje kleur vertoont. Van links naar rechts kun je zien hoe de kleur de intensiteit afneemt naarmate de concentratie wordt verdund, waardoor er meer oplosmiddel wordt toegevoegd.
Deze verdunning maakt het mogelijk om op deze manier een verdunde concentratie te verkrijgen uit een geconcentreerde. De kleur (en andere "verborgen" eigenschappen in de oranje kern) verandert op dezelfde manier als de concentratie, hetzij met fysische of chemische eenheden..
Maar wat zijn de chemische concentratie-eenheden? Onder hen zijn de molariteit of molaire concentratie van een oplossing, die het aantal mol opgeloste stof relateert aan het totale volume van de oplossing in liters.
Er is ook molaliteit of ook wel molaire concentratie genoemd, die verwijst naar de molen opgeloste stof maar die zijn opgenomen in een gestandaardiseerde hoeveelheid van het oplosmiddel of oplosmiddel dat precies één kilogram is.
Dit oplosmiddel kan zuiver zijn of als de oplossing meer dan één oplosmiddel bevat, is de molaliteit het aantal molen opgeloste stof per kilogram oplosmiddelmengsel..
En de derde eenheid van chemische concentratie is de normaliteit of normale concentratie van een oplossing die het aantal chemische equivalenten van de opgeloste stof per liter van de oplossing uitdrukt.
De eenheid waarin normaliteit wordt uitgedrukt, is in equivalenten per liter (Eq / L) en in de geneeskunde wordt de concentratie van elektrolyten in menselijk serum uitgedrukt in milli-equivalenten per liter (mEq / L).
Manieren om concentratie uit te drukken

De concentratie van een oplossing kan op drie manieren worden aangeduid, ook al hebben ze zelf een grote verscheidenheid aan termen en eenheden, die kunnen worden gebruikt om de maatstaf van deze waarde uit te drukken: kwalitatieve beschrijving, kwantitatieve notatie en classificatie in termen van oplosbaarheid.
Afhankelijk van de taal en context waarin u werkt, wordt een van de drie manieren gekozen om de concentratie van een mengsel uit te drukken.
Kwalitatieve beschrijving
De kwalitatieve beschrijving van de concentratie van een mengsel wordt voornamelijk gebruikt in informele en niet-technische taal en wordt uitgedrukt in de vorm van bijvoeglijke naamwoorden, die op een algemene manier het concentratieniveau aangeven dat een oplossing heeft.
Op deze manier is het minimale concentratieniveau volgens de kwalitatieve beschrijving dat van een "verdunde" oplossing, en het maximum is dat van "geconcentreerde"..
We spreken van verdunde oplossingen als een oplossing een zeer laag gehalte aan opgeloste stof heeft als functie van het totale volume van de oplossing. Als u een oplossing wilt verdunnen, moet u meer oplosmiddel toevoegen of een manier vinden om de opgeloste stof te verminderen.
Nu spreken we van geconcentreerde oplossingen wanneer ze een hoog gehalte aan opgeloste stof hebben als functie van het totale volume van de oplossing. Om een oplossing te concentreren, moet u meer opgeloste stof toevoegen of de hoeveelheid oplosmiddel verminderen.
In die zin wordt deze classificatie een kwalitatieve beschrijving genoemd, niet alleen omdat het wiskundige metingen mist, maar ook vanwege de empirische kwaliteit ervan (het kan worden toegeschreven aan visuele kenmerken, geuren en smaken, zonder dat wetenschappelijke tests nodig zijn)..
Classificatie op basis van oplosbaarheid
De oplosbaarheid van een concentratie geeft de maximale capaciteit van opgeloste stof aan die een oplossing heeft, afhankelijk van omstandigheden zoals temperatuur, druk en de stoffen die worden opgelost of in suspensie..
Oplossingen kunnen in drie typen worden ingedeeld op basis van hun niveau van opgeloste stof op het moment van meting: onverzadigde, verzadigde en oververzadigde oplossingen.
- Onverzadigde oplossingen zijn oplossingen die minder opgeloste stof bevatten dan de oplossing kan oplossen. In dit geval heeft de oplossing zijn maximale concentratie niet bereikt.
- Verzadigde oplossingen zijn oplossingen waarin de maximaal mogelijke hoeveelheid opgeloste stof bij een bepaalde temperatuur in het oplosmiddel is opgelost. In dit geval is er een evenwicht tussen beide stoffen en kan de oplossing niet meer opgeloste stof accepteren (aangezien deze zal neerslaan).
- Oververzadigde oplossingen hebben meer opgeloste stof dan de oplossing onder evenwichtsomstandigheden zou accepteren. Dit wordt bereikt door een verzadigde oplossing te verwarmen, waarbij meer opgeloste stof dan normaal wordt toegevoegd. Als het eenmaal koud is, zal het de opgeloste stof niet automatisch neerslaan, maar elke verstoring kan dit effect veroorzaken vanwege zijn instabiliteit..
Kwantitatieve notatie
Bij het bestuderen van een oplossing voor gebruik op technisch of wetenschappelijk gebied, is een precisie vereist die wordt gemeten en uitgedrukt in eenheden, die de concentratie beschrijft volgens de exacte waarden van massa en / of volume..
Dit is de reden waarom er een reeks eenheden is die wordt gebruikt om de concentratie van een oplossing in de kwantitatieve notatie uit te drukken, die zijn onderverdeeld in fysische en chemische, en die op hun beurt hun eigen onderverdelingen hebben..
De eenheden van fysische concentraties zijn die van "relatieve concentratie", die worden uitgedrukt in percentages. Er zijn drie manieren om procentuele concentraties uit te drukken: massapercentages, volumepercentages en massapercentages..
In plaats daarvan zijn eenheden van chemische concentraties gebaseerd op molaire hoeveelheden, gramequivalenten, delen per miljoen en andere kenmerken van de opgeloste stof ten opzichte van de oplossing..
Deze eenheden komen het meest voor vanwege hun hoge precisie bij het meten van concentraties, en om deze reden zijn dit meestal degenen die u wilt weten om met chemische oplossingen te werken..
Concentratie-eenheden
Zoals beschreven in de vorige paragrafen, moeten de berekeningen bij het kwantitatief karakteriseren van de concentratie van een oplossing worden beheerst door de bestaande eenheden voor dit doel..
Evenzo zijn de concentratie-eenheden onderverdeeld in die van relatieve concentratie, die van verdunde concentraties, die op basis van mol, en andere aanvullende..
Relatieve concentratie-eenheden
Relatieve concentraties zijn die uitgedrukt in percentages, zoals genoemd in de vorige paragraaf. Deze eenheden zijn onderverdeeld in massaprocent, volumeprocent en massaprocent en worden als volgt berekend:
- % massa = massa van opgeloste stof (g) / massa van totale oplossing (g) x 100
- % volume = volume opgeloste stof (ml) / volume totale oplossing (ml) x 100
- % massa / volume = massa van de opgeloste stof (g) / volume van de totale oplossing (ml) x 100
Om de massa of het volume van de totale oplossing te berekenen, moet in dit geval de massa of het volume van de opgeloste stof worden toegevoegd aan die van het oplosmiddel..
Eenheden van verdunde concentratie
De eenheden voor verdunde concentratie zijn eenheden die worden gebruikt om die zeer kleine concentraties uit te drukken die in de vorm van sporen in een verdunde oplossing worden aangetroffen; het meest voorkomende gebruik voor deze units is het vinden van sporen van het ene gas dat is opgelost in een ander gas, zoals stoffen die de lucht vervuilen.
Deze eenheden worden aangegeven in de vorm van delen per miljoen (ppm), delen per miljard (ppb) en delen per biljoen (ppt), en worden als volgt uitgedrukt:
- ppm = 1 mg opgeloste stof / 1 L oplossing
- ppb = 1 μg opgeloste stof / 1 L oplossing
- ppt = 1 ng opgeloste stof / 1 L oplossing
In deze uitdrukkingen is mg gelijk aan milligram (0,001 g), μg is gelijk aan microgram (0,000001 g) en ng is gelijk aan nanogram (0,000000001 g). Deze eenheden kunnen ook worden uitgedrukt als een functie van volume / volume.
Concentratie-eenheden als functie van mollen
De concentratie-eenheden op basis van mol zijn die van de molfractie, het molpercentage, de molariteit en de molaliteit (de laatste twee worden beter beschreven aan het einde van het artikel).
De molfractie van een stof is de fractie van al zijn samenstellende moleculen (of atomen) als functie van het totaal aan moleculen of atomen. Het wordt als volgt berekend:
XNAAR = aantal mol stof A / totaal aantal mol in oplossing
Deze procedure wordt herhaald voor de andere stoffen in oplossing, rekening houdend met het feit dat de som van XNAAR + XB + XC ... moet gelijk zijn aan één.
Het molpercentage wordt op dezelfde manier uitgewerkt als XNAAR, alleen als percentage:
Molair percentage van A = XNAAR x 100%
Het laatste deel zal molariteit en molaliteit in detail bespreken..
Formaliteit en normaliteit
Ten slotte zijn er twee concentratie-eenheden die momenteel in onbruik zijn: formaliteit en normaliteit..
De formaliteit van een oplossing vertegenwoordigt het aantal gewichts-formule-gram per liter totale oplossing. Het wordt uitgedrukt als:
F = nr. P.F.G / L-oplossing
In deze uitdrukking is P.F.G gelijk aan het gewicht van elk atoom van de stof, uitgedrukt in gram.
In plaats daarvan vertegenwoordigt normaliteit het aantal opgeloste equivalenten gedeeld door liters oplossing, zoals hieronder uitgedrukt:
N = equivalent gram opgeloste stof / L-oplossing
In deze uitdrukking kan het equivalent gram opgeloste stof worden berekend door het aantal mol H+, Oh- of andere methoden, afhankelijk van het type molecuul.
Molariteit
De molariteit of molaire concentratie van een opgeloste stof is de eenheid van chemische concentratie die de mol van de opgeloste stof (n) uitdrukt of relateert die zich in één (1) liter (L) van de oplossing bevinden..
Molariteit wordt aangeduid met de hoofdletter M en om het aantal mol van de opgeloste stof (n) te bepalen, worden de grammen van de opgeloste stof (g) gedeeld door het molecuulgewicht (MW) van de opgeloste stof..
Evenzo wordt het molecuulgewicht MW van de opgeloste stof verkregen uit de som van de atoomgewichten (PA) of de atoommassa van de chemische elementen, rekening houdend met de verhouding waarin ze combineren om de opgeloste stof te vormen. Verschillende opgeloste stoffen hebben dus hun eigen PM (hoewel dit niet altijd het geval is).
Deze definities worden samengevat in de volgende formules die worden gebruikt om de bijbehorende berekeningen uit te voeren:
Molariteit: M = n (mol opgeloste stof) / V (liter oplossing)
Aantal mol: n = g opgeloste stof / MW opgeloste stof
Oefening 1
Bereken de molariteit van een oplossing die is bereid met 45 g Ca (OH)twee opgelost in 250 ml water.
Het eerste dat u moet berekenen, is het molecuulgewicht van Ca (OH)twee (calcium hydroxide). Volgens de chemische formule bestaat de verbinding uit een calciumkation en twee hydroxylanionen. Hier is het gewicht van een elektron minder of aanvullend op de soort verwaarloosbaar, dus de atoomgewichten worden genomen:
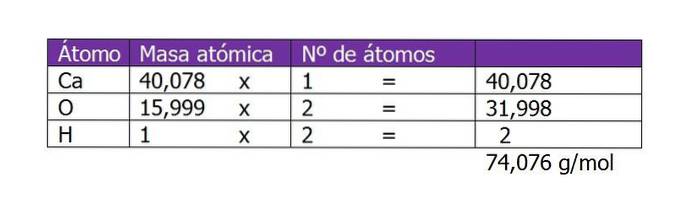
Het aantal mol van de opgeloste stof is dan:
n = 45 g / (74 g / mol)
n = 0,61 mol Ca (OH)twee
Er wordt 0,61 mol van de opgeloste stof verkregen, maar het is belangrijk om te onthouden dat deze mol opgelost ligt in 250 ml oplossing. Omdat de definitie van molariteit mollen in een liter of 1000 ml, dan moet een eenvoudige regel van drie worden gemaakt om de mollen te berekenen die in 1000 ml van de oplossing zitten
Als er in 250 ml oplossing => 0,61 mol opgeloste stof zit
In 1000 ml oplossing => x Hoeveel mollen zijn er?
x = (0,61 mol) (1000 ml) / 250 ml
X = 2,44 M (mol / L)
Een andere manier
De andere manier om de mollen te verkrijgen om de formule toe te passen, vereist dat de 250 ml in liters wordt gebracht, waarbij ook een regel van drie wordt toegepast:
Als 1000 ml => is 1 liter
250 ml => x Hoeveel liter zijn?
x = (250 ml) (1 L) / 1000 ml
x = 0,25 L.
Vervangen dan in de Molariteitsformule:
M = (0,61 mol opgeloste stof) / (0,25 l oplossing)
M = 2,44 mol / L
Oefening 2
Wat betekent het dat een HCl-oplossing 2,5 M is??
De HCl-oplossing is 2,5 molair, dat wil zeggen dat een liter ervan 2,5 mol zoutzuur heeft opgelost..
Normaal
De normaliteit of equivalente concentratie is de eenheid van chemische concentratie van de oplossingen die wordt aangeduid met de hoofdletter N. Deze concentratie-eenheid geeft de reactiviteit van de opgeloste stof aan en is gelijk aan het aantal equivalenten opgeloste stof (Eq) tussen het volume van de oplossing uitgedrukt in liters.
N = vergelijking / L
Het aantal equivalenten (Eq) is gelijk aan het aantal gram opgeloste stof gedeeld door het equivalentgewicht (PEq).
Eq = g opgeloste stof / PEq
Het equivalentgewicht, of ook wel gramequivalent genoemd, wordt berekend door het molecuulgewicht van de opgeloste stof te verkrijgen en deze te delen door een equivalente factor die voor het samenvatten in de vergelijking delta zeta (ΔZ) wordt genoemd..
PEq = PM / ΔZ
Berekening
De berekening van normaliteit zal een zeer specifieke variatie hebben in de equivalente factor of ΔZ, die ook afhangt van het type chemische reactie waaraan de opgeloste of reactieve soort deelneemt. Enkele gevallen van deze variatie kunnen hieronder worden genoemd:
-Als het om een zuur of base gaat, zal ΔZ of de equivalente factor gelijk zijn aan het aantal waterstofionen (H+ of hydroxyl OH- dat heeft de opgeloste stof. Zwavelzuur (H.tweeSW4) heeft twee equivalenten omdat het twee zure protonen heeft.
-Als het gaat om oxidatie-reductiereacties, komt ΔZ overeen met het aantal elektronen dat betrokken is bij het oxidatie- of reductieproces, afhankelijk van het specifieke geval. Dit is waar het balanceren van chemische vergelijkingen en de specificatie van de reactie een rol gaan spelen..
-Evenzo zal deze equivalente factor of ΔZ overeenkomen met het aantal ionen dat neerslaat in reacties die als neerslag worden geclassificeerd..
Oefening 1
Bepaal de normaliteit van 185 g NatweeSW4 gevonden in 1,3 liter oplossing.
Het molecuulgewicht van de opgeloste stof in deze oplossing wordt eerst berekend:
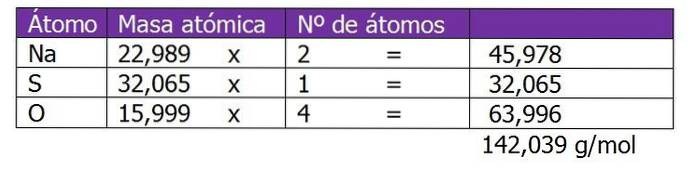
De tweede stap is om de equivalente factor of ΔZ te berekenen. In dit geval wordt, aangezien natriumsulfaat een zout is, rekening gehouden met de valentie of lading van het kation of metaal Na.+, die wordt vermenigvuldigd met 2, wat het subscript is van de chemische formule van zout of opgeloste stof:
NatweeSW4 => ∆Z = Valencia Kation x Subscript
∆Z = 1 x 2
Om het equivalentgewicht te verkrijgen, wordt het vervangen in de respectieve vergelijking:
PEq = (142,039 g / mol) / (2 Eq / mol)
PEq = 71,02 g / Eq
En dan kunt u doorgaan met het berekenen van het aantal equivalenten, opnieuw gebruikmakend van een andere eenvoudige berekening:
Vergelijking = (185 g) / (71,02 g / Eq)
Aantal equivalenten = 2,605 Eq
Eindelijk, met alle benodigde gegevens, wordt de normaliteit nu berekend door te substitueren volgens de definitie:
N = 2,605 Eq / 1,3 L
N = 2,0 N
Molaliteit
Molaliteit wordt aangeduid met de kleine letter m y is gelijk aan het aantal mol opgeloste stof dat aanwezig is in één (1) kilogram oplosmiddel. Het is ook bekend als molaire concentratie en wordt berekend met behulp van de volgende formule:
m = mol opgeloste stof / kg oplosmiddel
Terwijl molariteit de verhouding bepaalt van het aantal molen opgeloste stof in één (1) liter van de oplossing, heeft de molaliteit betrekking op het aantal molen opgeloste stof dat aanwezig is in één (1) kilogram oplosmiddel..
In die gevallen dat de oplossing wordt bereid met meer dan één oplosmiddel, zal de molaliteit hetzelfde aantal mol opgeloste stof per kilogram oplosmiddelmengsel uitdrukken..
Oefening 1
Bepaal de molaliteit van een oplossing die is bereid door 150 g sucrose (C.12H.220elf) met 300 g water.
Het molecuulgewicht van sucrose wordt eerst bepaald om verder te gaan met het berekenen van het aantal mol opgeloste stof in deze oplossing:
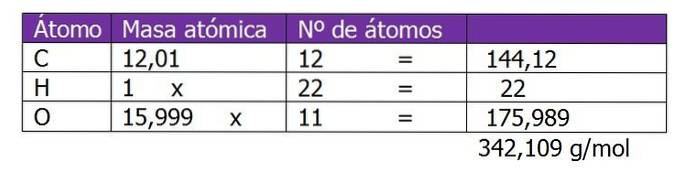
Het aantal mol sucrose wordt berekend:
n = (150 g sucrose) / (342,109 g / mol)
n = 0,438 mol sucrose
Vervolgens worden de grammen oplosmiddel naar kilogrammen gebracht om de uiteindelijke formule te kunnen toepassen.
Vervanging dan:
m = 0,438 mol sucrose / 0,3 kilogram water
m = 1,46 mol C12H.220elf/ Kg H.tweeOF
Hoewel er momenteel discussie is over de uiteindelijke uitdrukking van molaliteit, kan dit resultaat ook worden uitgedrukt als:
1,26 m C12H.220elf of 1,26 molal
Het wordt soms als voordelig beschouwd om de concentratie van de oplossing uit te drukken in termen van molaliteit, aangezien de massa van de opgeloste stof en het oplosmiddel geen kleine fluctuaties of onduidelijke veranderingen ondergaan als gevolg van de effecten van temperatuur of druk; zoals het gebeurt in oplossingen met gasvormige opgeloste stof.
Bovendien wordt erop gewezen dat deze concentratie-eenheid die naar een specifieke opgeloste stof verwijst, onveranderd blijft door de aanwezigheid van andere opgeloste stoffen in de oplossing..
Aanbevelingen en belangrijke opmerkingen over chemische concentratie
Het volume van de oplossing is altijd groter dan dat van het oplosmiddel
Als de oplossingsoefeningen zijn opgelost, ontstaat de fout bij het interpreteren van het volume van een oplossing alsof het dat van het oplosmiddel is. Als bijvoorbeeld een gram chocoladepoeder wordt opgelost in een liter water, is het volume van de oplossing niet gelijk aan dat van een liter water..
Waarom niet? Omdat de opgeloste stof altijd ruimte zal innemen tussen de oplosmiddelmoleculen. Als het oplosmiddel een hoge affiniteit heeft voor de opgeloste stof, kan de volumeverandering na oplossen verwaarloosbaar of verwaarloosbaar zijn..
Maar als dat niet het geval is, en nog meer als de hoeveelheid opgeloste stof groot is, moet rekening worden gehouden met de volumeverandering. Op deze manier zijn: Vsolvent + Vsolute = Vsolution. Alleen in verdunde oplossingen of waar de hoeveelheden opgeloste stof klein zijn, geldt Vsolvent = Vsolution.
Deze fout moet in gedachten worden gehouden, vooral bij het werken met vloeibare opgeloste stoffen. Als honing bijvoorbeeld wordt opgelost in alcohol in plaats van chocoladepoeder op te lossen, heeft het volume van de toegevoegde honing significante effecten op het totale volume van de oplossing..
Daarom moet in deze gevallen het volume van de opgeloste stof worden toegevoegd aan dat van het oplosmiddel..
Nut van molariteit
-Door de molariteit van een geconcentreerde oplossing te kennen, kunnen verdunningsberekeningen worden uitgevoerd met behulp van de eenvoudige formule M1V1 = M2V2, waarbij M1 overeenkomt met de initiële molariteit van de oplossing en M2 de molariteit van de oplossing die moet worden bereid uit de oplossing M1.
-Als je de molariteit van een oplossing kent, kan de normaliteit ervan eenvoudig worden berekend met behulp van de volgende formule: normaliteit = aantal equivalenten x M
De formules worden niet uit het hoofd geleerd, maar de eenheden of definities wel
Soms onthoudt het geheugen echter niet alle vergelijkingen die relevant zijn voor concentratieberekeningen. Hiervoor is het erg handig om van elk concept een zeer duidelijke definitie te hebben.
Vanuit de definitie worden de eenheden geschreven met de omrekeningsfactoren om die uit te drukken die overeenkomen met wat u wilt bepalen.
Als u bijvoorbeeld molaliteit heeft en u deze naar normaal wilt converteren, gaat u als volgt te werk:
(mol / kg oplosmiddel) x (kg / 1000 g) (g oplosmiddel / ml) (ml oplosmiddel / ml oplossing) (1000 ml / l) (Eq / mol)
Merk op dat (g oplosmiddel / ml) de dichtheid van het oplosmiddel is. De term (ml oplosmiddel / ml oplossing) verwijst naar hoeveel volume van de oplossing eigenlijk overeenkomt met het oplosmiddel. In veel oefeningen is deze laatste term om praktische redenen gelijk aan 1, hoewel het nooit helemaal waar is..
Referenties
- Inleidende chemie- 1st Canadese editie. Kwantitatieve eenheden van concentratie. Hoofdstuk 11 Oplossingen. Genomen uit: opentextbc.ca
- Wikipedia. (2018). Equivalente concentratie. Genomen uit: en.wikipedia.org
- PharmaFactz. (2018). Wat is molariteit? Overgenomen van: pharmafactz.com
- Whitten, Davis, Peck & Stanley. Chemie. (8e ed.). CENGAGE Leren, p 101-103, 512, 513.
- Waterige oplossingen-molariteit. Genomen uit: chem.ucla.edu
- Quimicas.net (2018). Voorbeelden van normaliteit. Hersteld van: quimicas.net.


Niemand heeft nog op dit artikel gereageerd.