
Boltzmann constante geschiedenis, vergelijkingen, calculus, oefeningen
De Boltzmann constant is de waarde die de gemiddelde kinetische energie van een thermodynamisch systeem of een object relateert aan zijn absolute temperatuur. Hoewel ze vaak door elkaar worden gehaald, zijn temperatuur en energie niet hetzelfde concept.
Temperatuur is een maatstaf voor energie, maar niet voor de energie zelf. Met de constante van Boltzmann zijn ze op de volgende manier met elkaar verbonden:
ENc = (3/2) kB T

Deze vergelijking is geldig voor een mono-atomair ideaal gasmolecuul met massa m, waar ENc is de kinetische energie gegeven in Joules, kB is de constante van Boltzmann en T is de absolute temperatuur in Kelvin.
Op deze manier neemt bij stijgende temperatuur ook de gemiddelde kinetische energie per molecuul stof toe, zoals te verwachten is. En het tegenovergestelde gebeurt wanneer de temperatuur daalt, het punt kunnen bereiken waar als alle beweging ophoudt, de laagst mogelijke temperatuur of het absolute nulpunt wordt bereikt..
Als we het hebben over gemiddelde kinetische energie, moet je onthouden dat kinetische energie geassocieerd is met beweging. En deeltjes kunnen op veel manieren bewegen, zoals bewegend, roterend of vibrerend. Natuurlijk zullen ze het niet allemaal op dezelfde manier doen, en aangezien ze ontelbaar zijn, wordt het gemiddelde genomen om het systeem te karakteriseren..
Sommige energietoestanden zijn waarschijnlijker dan andere. Dit concept is van radicaal belang in de thermodynamica. De energie die in de bovenstaande vergelijking wordt beschouwd, is translationele kinetische energie. De waarschijnlijkheid van toestanden en de relatie met de constante van Boltzmann zullen iets later worden besproken..
In 2018 werd de Kelvin opnieuw gedefinieerd en daarmee de Boltzmann-constante, die in het internationale systeem ongeveer 1.380649 x 10 is-2. 3 J. K-1. Er kan veel meer precisie worden bereikt voor de constante van Boltzmann, die met verschillende methoden in talloze laboratoria over de hele wereld is bepaald..
Artikel index
- 1 Geschiedenis
- 1.1 De constante van Boltzmann en de werken van Planck
- 2 Waarde en vergelijkingen
- 3 Boltzmann's constante en entropie
- 4 Hoe wordt kB berekend?
- 5 oefeningen opgelost
- 5.1 -Oefening 1
- 6 referenties
Verhaal
De beroemde constante dankt zijn naam aan de in Wenen geboren natuurkundige Ludwig Boltzmann (1844-1906), die zijn leven als wetenschapper wijdde aan de studie van het statistische gedrag van systemen met veel deeltjes, vanuit het oogpunt van de Newtoniaanse mechanica..
Hoewel het bestaan van het atoom tegenwoordig universeel wordt aanvaard, was in de negentiende eeuw de overtuiging of het atoom echt bestond of een kunstgreep was waarmee veel fysische verschijnselen werden verklaard, in volle discussie..
Boltzmann was een fervent verdediger van het bestaan van het atoom en kreeg in zijn tijd te maken met harde kritiek op zijn werk van vele collega's, die van mening waren dat het onoplosbare paradoxen bevatte..
Hij stelde dat waarneembare verschijnselen op macroscopisch niveau verklaard kunnen worden door de statistische eigenschappen van samenstellende deeltjes zoals atomen en moleculen..
Misschien waren deze kritiek te wijten aan de diepe episode van depressie die hem ertoe bracht om begin september 1906 van het leven te beroven, toen hij nog veel te doen had, aangezien hij werd beschouwd als een van de grote theoretische fysici van zijn tijd en er was er rest nog maar heel weinig dat andere wetenschappers bijdragen om de juistheid van hun theorieën te bevestigen.
Het duurde niet lang na zijn dood dat nieuwe ontdekkingen over de aard van het atoom en zijn samenstellende deeltjes optelden om te bewijzen dat Boltzmann gelijk had..
De constante van Boltzmann en de werken van Planck
Nu, de constante van Boltzmann kB het werd geïntroduceerd zoals het nu bekend is, enige tijd na het werk van de Oostenrijkse natuurkundige. Het was Max Planck, in zijn wet van de emissie van het zwarte lichaam, een werk dat hij in 1901 presenteerde, die het destijds de waarde gaf van 1,34 x 10-23 J / K.
Rond 1933 werd een plaquette met de definitie van entropie waarbij de beroemde constante betrokken was, toegevoegd aan de grafsteen van Boltzmann in Wenen als een postuum eerbetoon: S = kB log W, vergelijking die later zal worden besproken.
Tegenwoordig is de constante van Boltzmann onmisbaar bij de toepassing van de wetten van de thermodynamica, statistische mechanica en informatietheorie, velden waarvan deze trieste natuurkundige een pionier was..
Waarde en vergelijkingen
Gassen kunnen macroscopisch en ook microscopisch worden beschreven. Voor de eerste beschrijving zijn er begrippen als dichtheid, temperatuur en druk.
Houd er echter rekening mee dat een gas is samengesteld uit vele deeltjes, die een globale neiging hebben tot een bepaald gedrag. Het is deze trend die macroscopisch wordt gemeten. Een manier om de Boltzmann-constante te bepalen, is dankzij de bekende ideale gasvergelijking:
p.V = n. R. T
Hier p is de gasdruk, V. is het volume, n is het aantal aanwezige moedervlekken, R is de gasconstante en T is de temperatuur. In één mol ideaal gas wordt de volgende relatie tussen het product vervuld p.V, en de translationele kinetische energie K de hele set is:
p.V = (2/3). K
Daarom is de kinetische energie:
K = (3/2) n.R.T
Door te delen door het totale aantal aanwezige moleculen, die N genoemd zullen worden, wordt de gemiddelde kinetische energie van een enkel deeltje verkregen:
ENc = K / N
ENc (3 / 2N) n.R.T
In één mol zit het aantal deeltjes N van AvogadroNAAR, en daarom is het totale aantal deeltjes N nNA, resterend:
ENc = (3 / 2nNNAAR) n.R.T
Precies het quotiënt R / NNAAR is de constante van Boltzmann, waardoor wordt aangetoond dat de gemiddelde translatie-kinetische energie van een deeltje alleen afhangt van de absolute temperatuur T en niet van andere grootheden zoals druk, volume of zelfs het type molecuul:
ENc = (3/2) kB. T
Boltzmann's constante en entropie
Een gas heeft een bepaalde temperatuur, maar die temperatuur kan overeenkomen met verschillende toestanden van interne energie. Hoe u dit verschil kunt visualiseren?
Overweeg het gelijktijdig gooien van 4 munten en de manieren waarop ze kunnen vallen:
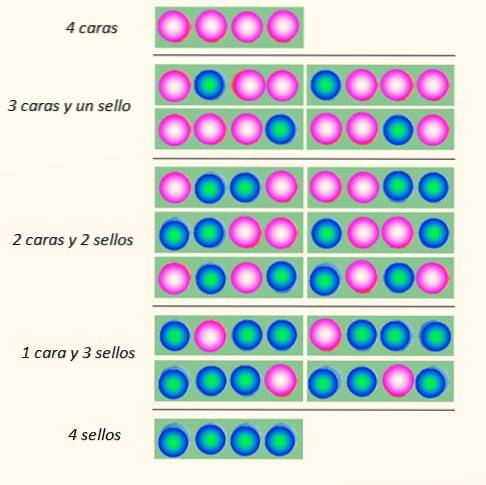
De set munten kan in totaal 5 staten aannemen, die in aanmerking worden genomen macroscopisch, beschreven in de afbeelding. Welke van deze staten zou volgens de lezer het meest waarschijnlijk zijn?
Het antwoord zou de toestand van 2 koppen en 2 staarten moeten zijn, want je hebt in totaal 6 mogelijkheden, van de 16 geïllustreerd in de figuur. En 24 = 16. Deze zijn gelijk aan de staten microscopisch.
Wat als er 20 munten worden gegooid in plaats van 4? Er zouden in totaal 2 zijntwintig mogelijkheden of "microscopische toestanden". Het is een veel groter aantal en moeilijker te hanteren. Om het verwerken van grote getallen te vergemakkelijken, zijn logaritmen zeer geschikt.
Wat nu duidelijk lijkt, is dat de staat met de meeste wanorde het meest waarschijnlijk is. Meer geordende staten zoals 4 koppen of 4 zegels zijn iets minder waarschijnlijk.
De entropie van een macroscopische toestand S wordt gedefinieerd als:
S = kB ln w
Waar w is het aantal mogelijke microscopische toestanden van het systeem en kB is de constante van Boltzmann. Wat ln w is dimensieloos, entropie heeft dezelfde eenheden als kB: Joule / K.
Dit is de beroemde vergelijking op de grafsteen van Boltzmann in Wenen. Echter, meer dan entropie, wat relevant is, is de verandering ervan:
ΔS = kB ln wtwee - kB ln w1 = kB ln (wtwee/ w1
Hoe bereken je kB?
De waarde van de constante van Boltzmann wordt experimenteel met uiterste precisie verkregen met metingen op basis van akoestische thermometrie, die worden uitgevoerd met behulp van de eigenschap die de afhankelijkheid van de geluidssnelheid in een gas met zijn temperatuur vaststelt.
Inderdaad, de geluidssnelheid in een gas wordt gegeven door:

Badiabatisch γp
En ρ is de dichtheid van het gas. Voor de bovenstaande vergelijking, p is de druk van het gas in kwestie en γ is de adiabatische coëfficiënt, waarvan de waarde voor een bepaald gas in tabellen wordt gevonden.
Metrologische instituten experimenteren ook met andere manieren om de constante te meten, zoals de Johnson Geluidsthermometrie, die thermische fluctuaties gebruikt die willekeurig optreden in materialen, met name geleiders.
Opgeloste oefeningen
-Oefening 1
Vind:
a) Gemiddelde translationele kinetische energie ENc die een ideaal gasmolecuul heeft bij 25 ºC
b) Translationele kinetische energie K van de moleculen in 1 mol van dit gas
c) De gemiddelde snelheid van een zuurstofmolecuul bij 25 ºC
Feit
mzuurstof = 16 x 10 -3 kg / mol
Oplossing
naar) ENc = (3/2) k T = 1,5 x 1,380649 x 10-2. 3J. K-1 x 298 K = 6,2 x 10-eenentwintig J
b) K = (3/2) n.R.T = 5 x 1 mol x 8,314 J / mol. K x 298 K = 3716 J
c) ENc ½ mvtwee, rekening houdend met het feit dat het zuurstofmolecuul diatomisch is en de molaire massa moet worden vermenigvuldigd met 2, hebben we:

Zoek de verandering in entropie wanneer 1 mol gas een volume van 0,5 m beslaat3 breidt uit tot 1 m3.
Oplossing
ΔS = kB ln (wtwee/ w1
wtwee= 2Nw1 (Er waren er 24 microscopisch kleine toestanden voor het gooien van de 4 munten, weet je nog?)
Waarbij N het aantal deeltjes is dat aanwezig is in 0,5 mol gas 0,5 x NNAAR
ΔS = kB ln (2N w1/ w1) = kB ln 2N= kB 0,5NNAAR ln 2 = 2,88 J / K
Referenties
- Atkins, P. 1999. Physical Chemistry. Omega-edities. 13-47.
- Bauer, W. 2011. Physics for Engineering and Sciences. Deel 1. Mc Graw Hill. 664-672.
- Giancoli, D. 2006. Natuurkunde: principes met toepassingen. 6e… Ed Prentice Hall. 443-444.
- Sears, Zemansky. 2016. Universitaire natuurkunde met moderne natuurkunde. 14e. Ed. Deel 1. 647-673.
- JA Herdefinitie. Kelvin: Boltzmann Constant. Teruggeplaatst van: nist.gov



Niemand heeft nog op dit artikel gereageerd.