
Chroomeigenschappen, kenmerken en toepassingen

De chroom (Cr) is een metalen element uit groep 6 (VIB) van het periodiek systeem. Tonnen van dit metaal worden jaarlijks geproduceerd door extractie uit het mineraal chromiet, ijzer of magnesium (FeCrtweeOF4, MgCrtweeOF4), die worden gereduceerd met koolstof om het metaal te verkrijgen. Het is zeer reactief en wordt alleen onder zeer reducerende omstandigheden in zijn zuivere vorm aangetroffen.
De naam is afgeleid van het Griekse woord 'chroma', wat kleur betekent. Het kreeg deze naam vanwege de veelvoudige en intense kleuren die worden vertoond door chroomverbindingen, of ze nu anorganisch of organisch zijn; van zwarte vaste stoffen of oplossingen tot geel, oranje, groen, paars, blauw en rood.

De kleur van metallisch chroom en zijn carbiden is echter zilverachtig grijsachtig. Deze eigenschap wordt benut in de verchroomtechniek om veel structuren zilveren glitters te geven (zoals die te zien zijn bij de krokodil in de bovenstaande afbeelding). Zo krijgen de stukken door "baden met chroom" glans en een grote weerstand tegen corrosie..
Chroom in oplossing reageert snel met zuurstof in de lucht om oxiden te vormen. Afhankelijk van de pH en oxidatieve omstandigheden van het medium, kan het verschillende oxidatiegetallen krijgen, zijnde (III) (Cr3+) de meest stabiele van allemaal. Bijgevolg chroom (III) oxide (CrtweeOF3) groen van kleur is de meest stabiele van zijn oxiden.
Deze oxiden kunnen een wisselwerking aangaan met andere metalen in de omgeving, waardoor bijvoorbeeld het pigment Siberisch rood lood (PbCrO4Dit pigment is geeloranje of rood (afhankelijk van zijn alkaliteit), en daaruit isoleerde de Franse wetenschapper Louis Nicolas Vauquelin metallisch koper, daarom wordt hij beloond als ontdekker.
Zijn mineralen en oxiden, evenals een klein deel van metallisch koper, zorgen ervoor dat dit element op nummer 22 staat van de meest voorkomende in de aardkorst..
De chemie van chroom is zeer divers omdat het bindingen kan vormen met bijna het hele periodiek systeem. Elk van zijn verbindingen vertoont kleuren die afhankelijk zijn van het oxidatiegetal, evenals de soorten die ermee interageren. Evenzo vormt het bindingen met koolstof en komt het tussen in een groot aantal organometaalverbindingen..
[TOC]
Kenmerken en eigenschappen
Chroom is een zilverachtig metaal in zijn zuivere vorm, met een atoomnummer van 24 en een molecuulgewicht van ongeveer 52 g / mol (52Cr, de meest stabiele isotoop).
Gezien zijn sterke metaalverbindingen heeft het hoge smeltpunten (1907 ºC) en kookpunten (2671 ºC). Ook maakt de kristallijne structuur het een zeer dicht metaal (7,19 g / ml).
Het reageert niet met water om hydroxiden te vormen, maar het reageert wel met zuren. Het oxideert met de zuurstof in de lucht en produceert in het algemeen chroomoxide, een veel gebruikt groen pigment..
Deze oxidelagen creëren wat bekend staat als passivering, het metaal beschermen tegen latere corrosie, aangezien zuurstof de metalen sinus niet kan binnendringen.
De elektronenconfiguratie is [Ar] 4s13d5, met alle elektronen ongepaard, en vertoont daarom paramagnetische eigenschappen. Het paren van elektronische spins kan echter optreden als het metaal wordt blootgesteld aan lage temperaturen en andere eigenschappen krijgt, zoals antiferromagnetisme..
Artikel index
- 1 Kenmerken en eigenschappen
- 2 Chemische structuur van chroom
- 3 oxidatie nummer
- 3.1 Cr (-2, -1 en 0)
- 3.2 Cr (I) en Cr (II)
- 3.3 Cr (III)
- 3,4 Cr (IV) en Cr (V)
- 3,5 Cr (VI): het chromaat-dichromaat-paar
- 4 Gebruik van chroom
- 4.1 Als kleurstof of pigmenten
- 4.2 In verchromen of metallurgie
- 4.3 Nutritioneel
- 5 Waar is?
- 6 referenties
Chroom chemische structuur
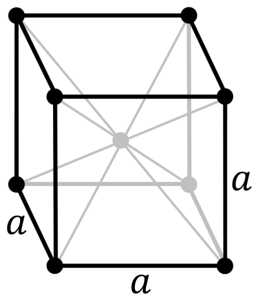
Wat is de structuur van verchroomd metaal? In zijn pure vorm neemt chroom een kubische (cc of bcc) kristalstructuur in het lichaam aan. Dit betekent dat het chroomatoom zich in het midden van een kubus bevindt, waarvan de randen worden ingenomen door andere chromaten (zoals in de afbeelding hierboven).
Deze structuur is verantwoordelijk voor chroom met hoge smelt- en kookpunten, evenals een grote hardheid. Koperatomen overlappen hun s- en d-orbitalen om geleidingsbanden te vormen volgens de bandtheorie.
Beide banden zijn dus halfvol. Waarom? Omdat de elektronenconfiguratie [Ar] 4s is13d5 en aangezien de s-orbitaal twee elektronen kan huisvesten, en de d-orbitalen tien. Dan wordt slechts de helft van de banden gevormd door hun overlappingen bezet door elektronen..
Met deze twee perspectieven - de kristallijne structuur en de metaalbinding - kunnen veel van de fysische eigenschappen van dit metaal in theorie worden verklaard. Noch verklaart echter waarom chroom verschillende oxidatietoestanden of -nummers kan hebben..
Dit vereist een diep begrip van de stabiliteit van het atoom met betrekking tot elektronische spins..
Oxidatiegetal
Omdat de elektronenconfiguratie van chroom [Ar] 4s is13d5 kan tot één of twee elektronen winnen (Cr1- en CRtwee-), of ze verliezen om verschillende oxidatiegetallen te verkrijgen.
Dus als chroom een elektron verliest, blijft het als [Ar] 4s03d5als hij drie verliest, [Ar] 4s03d3en als het ze allemaal verliest, [Ar], of wat gelijk is, zou het iso-elektronisch zijn voor argon.
Chroom verliest of verkrijgt geen elektronen door louter een gril: er moet een soort zijn die ze doneert of accepteert om van het ene oxidatiegetal naar het andere te gaan.
Chroom heeft de volgende oxidatienummers: -2, -1, 0, +1, +2, +3, +4, +5 en +6. Van hen +3, Cr3+, het is de meest stabiele en daarom overheersende van allemaal; gevolgd door +6, Cr6+.
Cr (-2, -1 en 0)
Het is zeer onwaarschijnlijk dat chroom elektronen verkrijgt, aangezien het een metaal is en daarom het van nature is om ze af te staan. Het kan echter coördineren met liganden, dat wil zeggen moleculen die een interactie aangaan met het metaalcentrum via een datieve binding..
Een van de bekendste is koolmonoxide (CO), dat de hexacarbonylverbinding van chroom vormt.
Deze verbinding heeft de molecuulformule Cr (CO)6, en aangezien de liganden neutraal zijn en geen enkele lading leveren, heeft Cr een oxidatiegetal van 0.
Dit kan ook worden waargenomen bij andere organometaalverbindingen zoals bis (benzeen) chroom. In de laatste is chroom omgeven door twee benzeenringen in een sandwich-achtige moleculaire structuur:
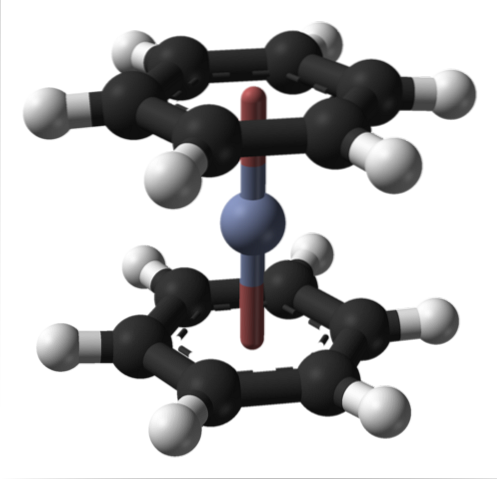
Uit deze twee organometaalverbindingen kunnen vele andere voortkomen uit Cr (0).
Er zijn zouten gevonden waar ze een interactie aangaan met natriumkationen, wat inhoudt dat Cr een negatief oxidatiegetal moet hebben om positieve ladingen aan te trekken: Cr (-2), Natwee[Cr (CO)5] en Cr (-1), Natwee[Crtwee(CO)10.
Cr (I) en Cr (II)
Cr (I) of Cr1+ Het wordt geproduceerd door de oxidatie van de zojuist beschreven organometaalverbindingen. Dit wordt bereikt door liganden, zoals CN of NO, te oxideren, waardoor bijvoorbeeld verbinding K wordt gevormd3[Cr (CN)5NIET].
Hier het feit dat je drie K-kationen hebt+ Het impliceert dat het chroomcomplex drie negatieve ladingen heeft; ook de ligand CN- draagt vijf negatieve ladingen bij, zodat tussen Cr en NO twee positieve ladingen moeten optellen (-5 + 2 = -3).
Als het NO neutraal is, is het Cr (II), maar als het een positieve lading heeft (NO+), is in dat geval Cr (I).
Aan de andere kant zijn Cr (II) -verbindingen overvloediger, waaronder de volgende: chroom (II) chloride (CrCltwee), chroomacetaat (Crtwee(OFtweeCCH34), chroom (II) oxide (CrO), chroom (II) sulfide (CrS) en meer.
Cr (III)
Van alle is het degene met de grootste stabiliteit, aangezien het in feite het product is van vele oxidatieve reacties van chromaationen. Misschien is de stabiliteit te danken aan de elektronische configuratie d3, waarin drie elektronen drie lagere energie d-orbitalen bezetten in vergelijking met de andere twee meer energetische (splitsing van d-orbitalen).
De meest representatieve verbinding van dit oxidatiegetal is chroom (III) oxide (CrtweeOF3Afhankelijk van de liganden die ermee coördineren, zal het complex een of andere kleur vertonen. Voorbeelden van deze verbindingen zijn: [CrCltwee(H.tweeOF)4] Cl, Cr (OH)3, CrF3, [Cr (HtweeOF)63+, enz.
Hoewel de chemische formule het op het eerste gezicht niet laat zien, heeft chroom gewoonlijk een octaëdrische coördinatiesfeer in zijn complexen; dat wil zeggen, het bevindt zich in het midden van een octaëder waar de hoekpunten worden gepositioneerd door de liganden (zes in totaal).
Cr (IV) en Cr (V)
De verbindingen waarin Cr deelneemt5+ zijn er zeer weinig, vanwege de elektronische instabiliteit van het genoemde atoom, en bovendien gemakkelijk geoxideerd te worden tot Cr6+, veel stabieler omdat het iso-elektronisch is in vergelijking met argon edelgas.
Cr (V) -verbindingen kunnen echter onder bepaalde omstandigheden worden gesynthetiseerd, zoals onder hoge druk. Evenzo hebben ze de neiging om te ontleden bij gematigde temperaturen, wat hun mogelijke toepassingen onmogelijk maakt omdat ze geen thermische weerstand hebben. Sommigen van hen zijn: CrF5 en K3[Cr (Otwee4] (de Otweetwee- is het peroxide-anion).
Aan de andere kant is de Cr4+ het is relatief stabieler en kan zijn gehalogeneerde verbindingen synthetiseren: CrF4, CrCl4 en CrBr4. Ze zijn echter ook vatbaar voor afbraak door redoxreacties om chroomatomen te produceren met betere oxidatiegetallen (zoals +3 of +6)..
Cr (VI): het chromaat-dichromaat-paar
2 [CrO4twee- + 2H+ (Geel) => [CrtweeOF7twee- + H.tweeO (Oranje)
De bovenstaande vergelijking komt overeen met de zure dimerisatie van twee chromaationen om dichromaat te produceren. De variatie in pH veroorzaakt een verandering in de interacties rond het metaalcentrum van Cr6+, ook duidelijk in de kleur van de oplossing (van geel naar oranje of omgekeerd). Dichromate bestaat uit een O-brug3Cr-O-CrO3.
Cr (VI) -verbindingen hebben de kenmerken dat ze schadelijk en zelfs kankerverwekkend zijn voor het menselijk lichaam en dieren.
Hoe? Studies stellen dat CrO-ionen4twee- dwars door celmembranen door de werking van sulfaattransporterende eiwitten (beide ionen zijn in feite vergelijkbaar in grootte).
Reductiemiddelen in cellen verminderen Cr (VI) tot Cr (III), dat zich ophoopt door onomkeerbare coördinatie met specifieke plaatsen op macromoleculen (zoals DNA).
De cel is verontreinigd met een teveel aan chroom en kan niet weggaan vanwege het ontbreken van een mechanisme dat het terug door de membranen transporteert.
Chromium gebruikt
Als kleurstof of pigmenten
Chroom heeft een breed scala aan toepassingen, van kleurstof voor verschillende soorten stoffen tot beschermer die metalen onderdelen verfraait in wat bekend staat als verchromen, dat kan worden gemaakt met puur metaal, of met Cr (III) -verbindingen of Cr (VI).
Chroomfluoride (CrF3) wordt bijvoorbeeld gebruikt als kleurstof voor wollen stoffen; chroomsulfaat (Crtwee(ZW43), het wordt gebruikt om email, keramiek, verf, inkt, lak te kleuren en het wordt ook gebruikt om metalen te verchromen; en chroomoxide (CrtweeOF3) vindt ook toepassing waar zijn aantrekkelijke groene kleur vereist is.
Daarom kan elk chroommineraal met intense kleuren bestemd zijn om een structuur te kleuren, maar daarna komt het feit naar voren of deze verbindingen al dan niet gevaarlijk zijn voor het milieu of voor de gezondheid van individuen..
In feite worden de giftige eigenschappen ervan gebruikt om hout en andere oppervlakken te beschermen tegen aantasting door insecten..
In chroom of metallurgie
Kleine hoeveelheden chroom worden ook aan het staal toegevoegd om het te versterken tegen oxidatie en om de glans te verbeteren. Dit komt doordat het in staat is grijsachtige carbiden te vormen (Cr3Ctwee) zeer goed bestand tegen reactie met zuurstof in de lucht.
Omdat chroom kan worden gepolijst tot glanzende oppervlakken, krijgt chroom vervolgens zilveren dessins en kleuren als een goedkoper alternatief voor deze doeleinden..
Voedingswaarde
Sommigen debatteren of chroom kan worden beschouwd als een essentieel element, dat wil zeggen onmisbaar in de dagelijkse voeding. Het is in zeer kleine concentraties in sommige voedingsmiddelen aanwezig, zoals groene bladeren en tomaten..
Evenzo zijn er eiwitsupplementen die de insulineactiviteit reguleren en de spiergroei bevorderen, zoals het geval is met chroompolynicotinaat..
Waar bevindt het zich?

Chroom komt voor in een grote verscheidenheid aan mineralen en edelstenen zoals robijnen en smaragden. Het belangrijkste mineraal waaruit chroom wordt gewonnen, is chromiet (MCrtweeOF4), waarbij M elk ander metaal kan zijn waarmee chroomoxide is geassocieerd. Deze mijnen zijn er in overvloed in Zuid-Afrika, India, Turkije, Finland, Brazilië en andere landen.
Elke bron heeft een of meer chromietvarianten. Op deze manier ontstaat voor elke M (Fe, Mg, Mn, Zn, etc.) een ander chroommineraal.
Om het metaal te extraheren, is het nodig om het mineraal te reduceren, dat wil zeggen om het centrum van chroommetaal elektronen te laten winnen door de werking van een reductiemiddel. Dit doe je met carbon of aluminium:
FeCrtweeOF4 + 4C => Fe + 2Cr + 4CO
Ook chromiet (PbCrO4.
Over het algemeen in elk mineraal waar het Cr ion3+ kan Al vervangen3+, beide met enigszins vergelijkbare ionische stralen, vormt een onzuiverheid die resulteert in een andere natuurlijke bron van dit verbazingwekkende, maar schadelijke metaal.
Referenties
- Tenenbaum E. Chroom. Genomen uit: chemistry.pomona.edu
- Wikipedia. (2018). Chroom. Genomen uit: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (6 april 2018). Wat is het verschil tussen Chrome en Chromium? Genomen van: thoughtco.com
- N.V. Mandich. (negentienvijfennegentig). Chemie van chroom. [Pdf]. Genomen uit: citeseerx.ist.psu.edu
- Chemie LibreTexts. Chemie van chroom. Genomen uit: chem.libretexts.org
- Saul 1. Shupack. (1991). De chemie van chroom en enkele resulterende analytische problemen. Beoordeeld van: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Chroom. Genomen uit: chemistryexplained.com

Niemand heeft nog op dit artikel gereageerd.