
Wat zijn de gewichtswetten van chemie? (Voorbeelden)
De gewichtswetten van de chemie Zij zijn degenen die hebben aangetoond dat de massa's van de stoffen die reageren dit niet willekeurig of lukraak doen; maar door een constant wiskundig aandeel van gehele getallen of submultipelen daarvan te handhaven, waarin de atomen van de elementen niet worden gecreëerd of vernietigd.
In het verleden vereiste het vaststellen van deze wetten buitengewone inspanningen om te redeneren; want hoewel het nu te duidelijk lijkt, voordat de atomaire of moleculaire massa's van de elementen of verbindingen, respectievelijk, niet eens bekend waren.

Omdat niet precies bekend was hoeveel één mol atomen van elk element gelijk was, moesten scheikundigen in de 18e en 19e eeuw vertrouwen op de reagerende massa's. Rudimentaire analytische balansen (bovenste afbeelding) waren dus onafscheidelijke metgezellen tijdens de honderden experimenten die nodig waren om de gewichtswetten vast te stellen..
Het is om deze reden dat wanneer je deze scheikundige wetten bestudeert, je op elk moment massametingen tegenkomt. Dankzij deze extrapolatie van de resultaten van de experimenten werd ontdekt dat de chemische verbindingen sigaren worden altijd gevormd met dezelfde massaverhouding van hun samenstellende elementen.
Artikel index
- 1 Wet van behoud van massa
- 1.1 -Lavoisier experimenten
- 1.2 -Balans van vergelijkingen
- 1.3 -Berekeningen
- 2 Wet van bepaalde verhoudingen
- 2.1 -Illustratie van de wet
- 2.2 -Toepassingen
- 2.3 -Berekeningen
- 3 Wet van meerdere proporties of de wet van Dalton
- 3.1 -Berekeningen
- 4 Wet van wederzijdse verhoudingen
- 4.1 -voorbeelden
- 5 referenties
Wet van behoud van massa
Deze wet zegt dat bij een chemische reactie de totale massa van de reactanten gelijk is aan de totale massa van de producten; zolang het beschouwde systeem gesloten is en er geen uitwisseling van massa en energie met zijn omgeving plaatsvindt.
Bij een chemische reactie verdwijnen stoffen niet, maar worden ze omgezet in andere stoffen met dezelfde massa; vandaar de beroemde zin: "niets wordt gemaakt, niets wordt vernietigd, alles wordt getransformeerd".
Historisch gezien werd de wet van behoud van massa in een chemische reactie voor het eerst voorgesteld in 1756 door Mikhail Lomonsov, die de resultaten van zijn experimenten in zijn dagboek liet zien..
Later in 1774 presenteerde Antoine Levoisier, de Franse chemicus, de resultaten van zijn experimenten die dit mogelijk maakten; die, sommigen het ook de wet van Lavoisier noemen.
-Lavoisier experimenten
In de tijd van Lavoisier (1743-1794) was er de Phlogiston-theorie, volgens welke lichamen het vermogen hadden om in brand te vliegen of te verbranden. De experimenten van Lavoisier maakten het mogelijk om deze theorie terzijde te schuiven.
Lavoisier voerde talloze experimenten met metaalverbranding uit. Hij woog zorgvuldig de materialen voor en na verbranding in een gesloten container en ontdekte dat er een duidelijke gewichtstoename was..
Maar Lavoiser, gebaseerd op zijn kennis van de rol van zuurstof bij verbranding, concludeerde dat de gewichtstoename bij verbranding te wijten was aan de opname van zuurstof in het brandende materiaal. Het concept van metaaloxiden was geboren.
Daarom bleef de som van de massa's van de verbrande metalen en van de zuurstof ongewijzigd. Deze conclusie maakte het mogelijk de wet van behoud van massa vast te stellen.
-Vergelijking balanceren
De wet van behoud van massa stelde de noodzaak vast om chemische vergelijkingen in evenwicht te brengen, wat garandeert dat het aantal elementen dat deelneemt aan een chemische reactie, zowel als reactanten als als producten, exact hetzelfde is..
Dit is een essentiële vereiste voor de nauwkeurigheid van de uit te voeren stoichiometrische berekeningen..
-Berekeningen
Watermollen
Hoeveel mol water kan er worden geproduceerd bij de verbranding van 5 mol methaan in overmaat zuurstof? Laat ook zien dat aan de wet van behoud van materie is voldaan..
CH4 + 2 Otwee => COtwee + 2 uurtweeOF
Als we de uitgebalanceerde vergelijking van de reactie observeren, wordt geconcludeerd dat 1 mol methaan 2 mol water produceert.
Het probleem is direct op te lossen met een simpele aanpak, aangezien we niet 1 mol maar 5 mol CH hebben4
Mol water = 5 mol CH4(2 mol HtweeO / 1 mol CH4
= 10
Dat komt overeen met 180 g H.tweeO. Vormde ook 5 mol of 220 g COtwee, wat gelijk is aan een totale massa van 400 g producten.
Dus om aan de wet van behoud van materie te voldoen, moet 400 g reagentia reageren; niet meer niet minder. Van die 400 g komt 80 g overeen met 5 mol CH4 (vermenigvuldigd met de molecuulmassa van 16 g / mol), en 320 g bij 10 mol Otwee (evenzo voor zijn molecuulmassa van 32 g / mol).
Verbranding van een magnesiumlint
Een magnesiumlint van 1,50 g werd verbrand in een gesloten houder die 0,80 g zuurstof bevatte. Na verbranding bleef 0,25 g zuurstof in de houder. a) Welke massa zuurstof reageerde? b) Hoeveel magnesiumoxide werd gevormd?
De massa zuurstof die reageerde, wordt verkregen door een eenvoudig verschil.
Massa verbruikte zuurstof = (aanvankelijke massa - restmassa) zuurstof
= 0,80 g - 0,25 g
= 0,55 g Otwee (naar)
Volgens de wet van behoud van massa,
Massa magnesiumoxide = massa magnesium + massa zuurstof
= 1,50 g + 0,55 g
= 2,05 g MgO (b)
Wet van welomlijnde proporties
Joseph Louis Proust (1754-1826), Franse chemicus, realiseerde zich dat in een chemische reactie de chemische elementen altijd reageren in vaste verhoudingen van massa's om een verbinding te vormen zuiver specifiek; daarom is de samenstelling constant, ongeacht de bron of oorsprong, of hoe het wordt gesynthetiseerd.
Proust verkondigde in 1799 de wet van bepaalde proporties, die stelt dat: "Wanneer twee of meer elementen samen een verbinding vormen, doen ze dat in een vaste massaverhouding." Deze relatie ligt dan vast en is niet afhankelijk van de strategie die wordt gevolgd voor de bereiding van de verbinding..
Deze wet staat ook bekend als de wet van constante samenstelling, die stelt dat: "Elke chemische verbinding in een staat van zuiverheid altijd dezelfde elementen bevat, in een constante massaverhouding.".
-Wet illustratie
IJzer (Fe) reageert met zwavel (S) om ijzersulfide (FeS) te vormen, er kunnen drie situaties worden opgemerkt (1, 2 en 3):
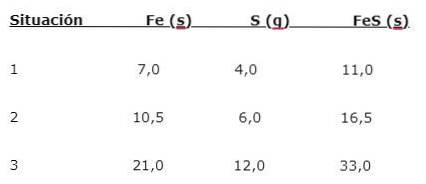
Om de verhouding te vinden waarin de elementen worden gecombineerd, deelt u de grotere massa (Fe) door de kleinere massa (S). De berekening geeft een verhouding van 1,75: 1. Deze waarde wordt herhaald in de drie gegeven voorwaarden (1, 2 en 3), waarbij dezelfde verhouding wordt verkregen hoewel verschillende massa's worden gebruikt..
Dat wil zeggen, 1,75 g Fe wordt gecombineerd met 1,0 g S om 2,75 g FeS te geven.
-Toepassingen
Door deze wet toe te passen, is het mogelijk om precies de massa van de elementen te weten die moeten worden gecombineerd om een gewenste massa van een verbinding te verkrijgen..
Op deze manier kan informatie worden verkregen over de overtollige massa van elk van de elementen die bij een chemische reactie betrokken zijn, of dat er een beperkend reagens in de reactie aanwezig is..
Bovendien wordt het toegepast om de centesimale samenstelling van een verbinding te kennen, en op basis van de laatste kan de formule van een verbinding worden vastgesteld.
Centesimale samenstelling van een verbinding
Kooldioxide (COtwee) wordt gevormd in de volgende reactie:
C + Otwee => COtwee
12 g koolstof combineert 32 g zuurstof om 44 g kooldioxide te geven.
Dus het percentage koolstof is gelijk
Koolstofpercentage = (12 g / 44 g) 100%
= 27,3%
Zuurstofpercentage = (32 g / 44 g) 100%
Percentage zuurstof = 72,7%
Met behulp van de verklaring van de wet van constante samenstelling kan worden opgemerkt dat kooldioxide altijd bestaat uit 27,3% koolstof en 72,7% zuurstof.
-Berekeningen
Zwaveltrioxide
Toen 4 g en 6 g zwavel (S) met zuurstof (O) in verschillende vaten werden gereageerd, 10 g en 15 g zwaveltrioxide (SO3.
Waarom werden zulke hoeveelheden zwaveltrioxide verkregen en niet andere??
Bereken ook de hoeveelheid zwavel die nodig is om te combineren met 36 g zuurstof en de verkregen massa zwaveltrioxide.
Deel A)
In de eerste container wordt 4 zwavel gemengd met X g zuurstof om 10 g trioxide te verkrijgen. Als de wet van behoud van massa wordt toegepast, kunnen we een oplossing vinden voor de massa zuurstof die gecombineerd is met de zwavel.
Zuurstofmassa = 10 g zuurstoftrioxide - 4 g zwavel.
= 6 g
In container 2 wordt 6 g zwavel gemengd met X g zuurstof om 15 zwaveltrioxide te verkrijgen.
Zuurstofmassa = 15 g zwaveltrioxide - 6 g zwavel
= 9 g
We gaan vervolgens verder met het berekenen van de O / S-ratio's voor elke container:
O / S-verhouding in situatie 1 = 6 g O / 4 g S.
= 1,5 / 1
O / S-verhouding in situatie 2 = 9 g O / 6 g S.
= 1,5 / 1
Dat is in overeenstemming met wat wordt vermeld in de wet van gedefinieerde verhoudingen, wat aangeeft dat de elementen altijd in dezelfde verhouding combineren om een bepaalde verbinding te vormen..
Daarom zijn de verkregen waarden correct en corresponderen deze met de toepassing van de wet.
Deel b)
In de vorige paragraaf is een waarde van 1,5 / 1 berekend voor de O / S-verhouding.
g zwavel = 36 zuurstof (1 g zwavel / 1,5 g zuurstof)
= 24 g
g zwaveltrioxide = 36 g zuurstof + 24 g zwavel
= 60 g
Chloor en magnesium
Chloor en magnesium worden gecombineerd in de verhouding van 2,95 g chloor op elke g magnesium. a) Bepaal de massa chloor en magnesium die nodig zijn om 25 g magnesiumchloride te verkrijgen. b) Wat is de procentuele samenstelling van magnesiumchloride?
Deel A)
Gebaseerd op de waarde 2,95 voor de Cl: Mg-verhouding, kan de volgende benadering worden gemaakt:
2,95 g Cl + 1 g Mg => 3,95 g MgCltwee
Later:
g Cl = 25 g MgCltwee (2,95 g Cl / 3,95 g MgCltwee
= 18,67
g Mg = 25 g MgCltwee (1 g Mg / 3,95 g MgCltwee
= 6,33
Dus 18,67 g chloor wordt gecombineerd met 6,33 g magnesium om 25 g magnesiumchloride te produceren..
Deel b)
Bereken eerst de molecuulmassa van magnesiumchloride, MgCltwee
Molecuulgewicht MgCltwee = 24,3 g / mol + (2 35,5 g / mol)
= 95,3 g / mol
Magnesiumpercentage = (24,3 g / 95,3 g) x 100%
= 25,5%
Chloorpercentage = (71 g / 95,3 g) x 100%
= 74,5%
Wet van meerdere proporties of de wet van Dalton
De wet werd in 1803 uitgevaardigd door de Franse chemicus en meteoroloog John Dalton, op basis van zijn observaties met betrekking tot de reacties van atmosferische gassen.
De wet werd op de volgende manier geformuleerd: "Wanneer elementen worden gecombineerd om meer dan één verbinding te geven, voegt een variabele massa van een van hen een vaste massa van de andere samen en de eerste heeft een relatie tussen canonieke en onduidelijke getallen".
Ook: "Wanneer twee elementen worden gecombineerd om verschillende verbindingen voort te brengen, gegeven een vaste hoeveelheid van een ervan, zijn de verschillende hoeveelheden van het andere element die worden gecombineerd met de genoemde vaste hoeveelheid om de verbindingen te produceren, in relatie tot eenvoudige gehele getallen".
John Dalton maakte de eerste moderne beschrijving van het atoom als een onderdeel van de chemische elementen, toen hij erop wees dat de elementen bestaan uit ondeelbare deeltjes die atomen worden genoemd..
Bovendien stelde hij dat verbindingen worden gevormd wanneer atomen van verschillende elementen met elkaar worden gecombineerd in eenvoudige gehele verhoudingen..
Dalton voltooide het onderzoekswerk van Proust. Hij wees op het bestaan van twee tinoxiden, met percentages van 88,1% en 78,7% tin met de overeenkomstige percentages zuurstof, respectievelijk 11,9% en 21,3%..
-Berekeningen
Water en waterstofperoxide
Laat zien dat de verbindingen water, HtweeO, en waterstofperoxide, HtweeOFtwee, voldoen aan de wet van meervoudige verhoudingen.
Atoomgewichten van de elementen: H = 1 g / mol en zuurstof = 16 g / mol.
Molecuulgewichten van verbindingen: H.tweeO = 18 g / mol en HtweeOFtwee = 34 g / mol.
Waterstof is het element met een vaste hoeveelheid in H.tweeO en HtweeOFtwee, dus de verhoudingen tussen O en H in beide verbindingen zullen worden vastgesteld.
O / H-verhouding in H.tweeO = (16 g / mol) / (2 g / mol)
= 8/1
O / H-verhouding in H.tweeOFtwee = (32 g / mol) / (2 g / mol)
= 16/1
Verband tussen beide verhoudingen = (16/1) / (8/1)
= 2
Dus de O / H-verhouding van waterstofperoxide tot water is 2, een eenvoudig geheel getal. Daarom wordt naleving van de wet van meervoudige verhoudingen aangetoond..
Stikstofoxiden
Welke massa zuurstof combineert met 3,0 g stikstof in a) stikstofmonoxide, NO en b) stikstofdioxide, NOtwee. Laat zien dat NEE en NEEtwee voldoen aan de wet van meervoudige verhoudingen.
Massa stikstof = 3 g
Atoomgewichten: stikstof, 14 g / mol, en zuurstof, 16 g / mol.
Berekeningen
In NO combineert één N-atoom met 1 O-atoom, dus de massa zuurstof die wordt gecombineerd met 3 g stikstof kan als volgt worden berekend:
g O = g stikstof · (PA. O / PA. N)
= 3 g (16 g / mol / 14 g / mol)
= 3,43 g O
In de NOtwee, één N-atoom combineert met 2 O-atomen, dus de massa zuurstof die wordt gecombineerd is:
g zuurstof = 3 g (32 g / mol / 14 g / mol)
= 6,86 g O
O / N-verhouding in NO = 3,43 g O / 3 g N
= 1.143
O / N-verhouding in NOtwee = 6,86 g O / 3 g N
= 2.282
Waarde van de relatie tussen de O / N-verhoudingen = 2.282 / 1.143
= 2
Dus de waarde van de O / N-verhouding is 2, een eenvoudig geheel getal. Daarom is de wet van meerdere verhoudingen vervuld..
Wederzijdse verhoudingen wet
Deze wet, opgesteld door Richter en Carl F. Wenzel afzonderlijk, stelt vast dat de massaverhoudingen van twee verbindingen met een element gemeenschappelijk, het mogelijk maakt om het aandeel van een derde verbinding tussen de andere elementen te bepalen als ze reageren..
Als u bijvoorbeeld de twee verbindingen AB en CB heeft, kunt u zien dat het gemeenschappelijke element B is.
De wet van Richter-Wenzel of de wet van wederzijdse verhoudingen zegt dat, wetende hoeveel van A reageert met B om AB te geven, en hoeveel van C reageert met B om CB te geven, we de massa van A kunnen berekenen die nodig is om te reageren met een massa van C om AC te vormen.
En het resultaat is dat de verhouding A: C of A / C een veelvoud of een submultipel moet zijn van A / B of C / B. Aan deze wet wordt echter niet altijd voldaan, vooral niet wanneer de elementen verschillende oxidatietoestanden vertonen..
Van alle fundamentele wetten is dit misschien wel de meest "abstracte" of gecompliceerde. Maar als het wordt geanalyseerd vanuit een wiskundig oogpunt, zal blijken dat het alleen bestaat uit omrekeningsfactoren en annuleringen.
-Voorbeelden
Methaan
Als bekend is dat 12 g koolstof reageert met 32 g zuurstof om kooldioxide te vormen; en dat, aan de andere kant, 2 g waterstof reageert met 16 g zuurstof om water te vormen, dan kunnen de massaverhoudingen C / O en H / O voor CO worden geschattwee en HtweeOf, respectievelijk.
Bij het berekenen van C / O en H / O hebben we:
C / O = 12 g C / 32 g O
= 3/8
H / O = 2 g H / 16 g O
= 1/8
Zuurstof is het gemeenschappelijke element en je wilt weten hoeveel koolstof reageert met waterstof om methaan te produceren; dat wil zeggen, u wilt C / H (of H / C) berekenen. Vervolgens is het nodig om de voorgaande verhoudingen te verdelen om te laten zien of aan wederkerigheid is voldaan:
C / H = (C / O) / (H / O)
Merk op dat op deze manier de O's worden geannuleerd en C / H blijft:
C / H = (3/8) / (1/8)
= 3
En 3 is een veelvoud van 3/8 (3/8 x 8). Dit betekent dat 3 g C reageert met 1 g H om methaan te geven. Maar om het te kunnen vergelijken met COtwee, vermenigvuldig C / H met 4, wat gelijk is aan 12; dit geeft 12 g C dat reageert met 4 g H om methaan te vormen, wat ook waar is.
Magnesiumsulfide
Als bekend is dat 24 g magnesium reageert met 2 g waterstof om magnesiumhydride te vormen; en dat bovendien 32 g zwavel reageert met 2 g waterstof om waterstofsulfide te vormen, het gemeenschappelijke element is waterstof en we willen Mg / S berekenen uit Mg / H en H / S.
Als we vervolgens Mg / H en H / S afzonderlijk berekenen, hebben we:
Mg / H = 24 g Mg / 2 g H
= 12
H / S = 2 g H / 32 g S.
= 1/16
Het is echter handig om S / H te gebruiken om de H te annuleren. Daarom is S / H gelijk aan 16. Zodra dit is gebeurd, gaan we verder met het berekenen van Mg / S:
Mg / S = (Mg / H) / (S / H)
= (12/16)
= 3/4
En 3/4 is een veelvoud van 12 (3/4 x 16). De Mg / S-verhouding geeft aan dat 3 g Mg reageert met 4 g zwavel om magnesiumsulfide te vormen. U moet Mg / S echter met 8 vermenigvuldigen om het te kunnen vergelijken met Mg / H. Dus 24 g Mg reageert met 32 g zwavel om dit metaalsulfide te geven.
Aluminiumchloride
Het is bekend dat 35,5 g Cl reageert met 1 g H om HCl te vormen. Evenzo reageert 27 g Al met 3 g H om AlH te vormen3. Bereken het aandeel aluminiumchloride en bepaal of een dergelijke verbinding voldoet aan de wet van Richter-Wenzel.
Nogmaals, we gaan verder met het afzonderlijk berekenen van Cl / H en Al / H:
Cl / H = 35,5 g Cl / 1 g H
= 35,5
Al / H = 27 g Al / 3 g H
= 9
Nu wordt Al / Cl berekend:
Al / Cl = (Al / H) / (Cl / H)
= 9 / 35,5
≈ 0,250 of 1/4 (eigenlijk 0,253)
Dat wil zeggen, 0,250 g Al reageert met 1 g Cl om het overeenkomstige zout te vormen. Maar nogmaals, Al / Cl moet worden vermenigvuldigd met een getal waarmee het (gemakshalve) kan worden vergeleken met Al / H.
Onnauwkeurigheden in de berekening
Al / Cl wordt dan vermenigvuldigd met 108 (27 / 0,250), wat 27 g Al geeft dat reageert met 108 g Cl. Dit is niet precies het geval. Als we bijvoorbeeld de waarde 0,253 keer Al / Cl nemen, en deze vermenigvuldigen met 106,7 (27 / 0,253), dan hebben we dat 27 g Al reageert met 106,7 g Cl; die dichter bij de realiteit staat (AlCl3, met een PA van 35,5 g / mol voor Cl).
Dit is hoe de wet van Richter kan haperen door precisie en het misbruik van decimalen..
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Flores, J. Química (2002). Redactioneel Santillana.
- Joaquín San Frutos Fernández. (s.f.). De overwegingen en volumetrische wetten. Hersteld van: encina.pntic.mec.es
- Toppr. (s.f.). Wetten van chemische combinatie. Hersteld van: toppr.com
- Briljant. (2019). Wetten van chemische combinatie. Hersteld van: brilliant.org
- Chemie LibreTexts. (2015, 15 juli). Fundamentele chemische wetten. Hersteld van: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (18 januari 2019). Wet van behoud van massa. Hersteld van: thoughtco.com


Niemand heeft nog op dit artikel gereageerd.