
Moeller-diagram van wat het inhoudt en oefeningen opgelost
De Moeller diagram o Rain-methode is een grafische en geheugensteuntje om de regel van Madelung te leren kennen; dat wil zeggen, hoe de elektronenconfiguratie van een element moet worden geschreven. Het wordt gekenmerkt door het tekenen van diagonalen door de kolommen van de orbitalen, en door de richting van de pijl te volgen, wordt de juiste volgorde van hetzelfde voor een atoom vastgesteld.
In sommige delen van de wereld wordt het Moeller-diagram ook wel de regen methode. Hierdoor wordt een volgorde gedefinieerd in het vullen van de orbitalen, die ook worden bepaald door de drie kwantumgetallen n, l Y ml.
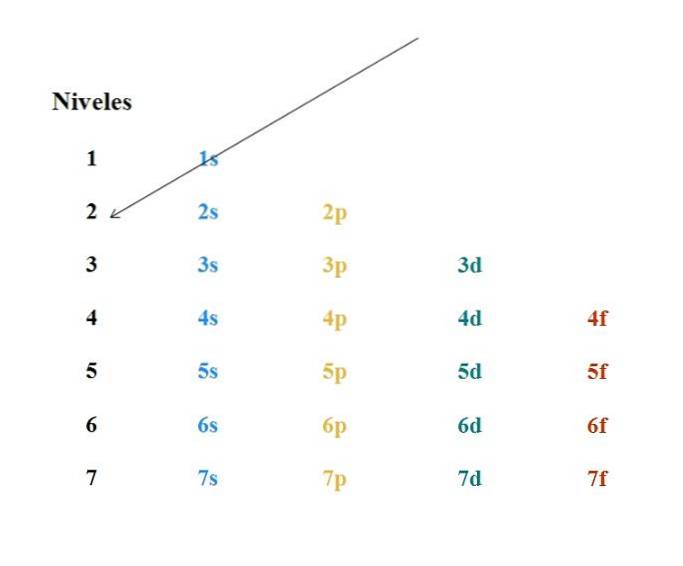
Een eenvoudig Moeller-diagram wordt getoond in de bovenstaande afbeelding. Elke kolom komt overeen met verschillende orbitalen: s, p, d en f, met hun respectievelijke energieniveaus. De eerste pijl geeft aan dat het vullen van een atoom moet beginnen met de 1s-orbitaal.
De volgende pijl moet dus beginnen vanuit de 2s-orbitaal en dan van de 2p tot en met de 3s-orbitaal. Op deze manier, alsof het een regen is, worden de orbitalen en het aantal elektronen dat ze bevatten (4l+twee).
Het Moeller-diagram is een inleiding voor degenen die elektronenconfiguraties bestuderen..
Artikel index
- 1 Wat is het Moeller-diagram?
- 1.1 Madelung's regel
- 1.2 Te volgen stappen
- 2 Opgeloste oefeningen
- 2.1 Beryllium
- 2.2 Fosfor
- 2.3 Zirkonium
- 2.4 Iridium
- 2.5 Uitzonderingen op het Moeller-diagram en de regel van Madelung
- 3 referenties
Wat is het Moeller-diagram?
Madelung's regel
Aangezien het Moeller-diagram bestaat uit een grafische weergave van de regel van Madelung, is het noodzakelijk om te weten hoe deze laatste werkt. Het vullen van de orbitalen moet aan de volgende twee regels voldoen:
-De orbitalen met de laagste waarden van n+l worden eerst gevuld, zijnde n het belangrijkste kwantumgetal, en l het orbitale impulsmoment. De 3d-orbitaal komt bijvoorbeeld overeen met n= 3 en l= 2, dus, n+l= 3 + 2 = 5; ondertussen komt de 4s-orbitaal overeen met n= 4 en l= 0, en n+l= 4 + 0 = 4. Uit het bovenstaande blijkt dat de elektronen eerst de 4s-orbitaal vullen dan de 3d.
-Als twee orbitalen dezelfde waarde hebben van n+l, de elektronen bezetten als eerste degene met de laagste waarde van n. De 3d-orbitaal heeft bijvoorbeeld de waarde n+l= 5, zoals de 4p-orbitaal (4 + 1 = 5); maar aangezien 3d de kleinste waarde heeft van n, zal eerder vol zijn dan 16.00 uur.
Uit de twee voorgaande waarnemingen kan de volgende volgorde van vullen van de orbitalen worden bereikt: 1s 2s 2p 3s 3p 4s 3d 4p.
Volg dezelfde stappen voor verschillende waarden van n+l voor elke orbitaal worden de elektronische configuraties van andere atomen verkregen; die op zijn beurt ook grafisch kan worden bepaald door het Moeller-diagram.
Te volgen stappen
De regel van Madelung stelt de formule n+l, waarmee de elektronische configuratie kan worden "gewapend". Zoals gezegd geeft het Moeller-diagram dit echter al grafisch weer; dus volg gewoon de kolommen en teken stap voor stap diagonalen.
Hoe start je dan de elektronische configuratie van een atoom? Om dit te doen, moet je eerst het atoomnummer Z weten, dat voor een neutraal atoom per definitie gelijk is aan het aantal elektronen.
Dus met Z wordt het aantal elektronen verkregen, en met dit in gedachten beginnen we diagonalen te tekenen door het Moeller-diagram.
De orbitalen van de s kunnen twee elektronen herbergen (volgens de formule 4l+2), de zes elektronen, de d tien en de veertien. Het stopt bij de orbitaal waar het laatste elektron gegeven door Z is bezet.
Voor verdere verduidelijking staan hieronder een reeks opgeloste oefeningen.
Opgeloste oefeningen
Beryllium
Met behulp van het periodiek systeem bevindt het element beryllium zich met een Z = 4; dat wil zeggen, zijn vier elektronen moeten in de orbitalen worden ondergebracht.
Beginnend met de eerste pijl in het Moeller-diagram, bezet de 1s-orbitaal twee elektronen: 1stweegevolgd door de 2s-orbitaal, met twee extra elektronen om op te tellen tot 4 in totaal: 2stwee.
Daarom is de elektronenconfiguratie van beryllium, uitgedrukt als [Be], 1stwee2 sectwee. Merk op dat de som van de superscripts gelijk is aan het totale aantal elektronen.
Bij elkaar passen
Het element fosfor heeft een Z = 15 en daarom heeft het in totaal 15 elektronen die de orbitalen moeten bezetten. Om verder te komen, begin je meteen met de 1s-instellingtwee2 sectwee, die 4 elektronen bevat. Dan zouden er nog 9 elektronen ontbreken.
Na de 2s-orbitaal "komt" de volgende pijl door de 2p-orbitaal en landt uiteindelijk in de 3s-orbitaal. Omdat de 2p-orbitalen 6 elektronen kunnen innemen en de 3s 2 elektronen, hebben we: 1stwee2 sectwee2 Blz63stwee.
Er ontbreken nog 3 elektronen, die volgens het Moeller-diagram de volgende 3p-orbitaal bezetten: 1stwee2 sectwee2 Blz63stwee3p3, elektronenconfiguratie van fosfor [P].
Zirkonium
Het element zirkonium heeft een Z = 40. Pad verkorten met 1s-opstellingtwee2 sectwee2 Blz63stwee3p6, met 18 elektronen (die van het edelgas argon), dan zouden er nog 22 elektronen ontbreken. Na de 3p-orbitaal zijn de volgende te vullen volgens het Moeller-diagram de 4s, 3d, 4p en 5s orbitalen.
Ze volledig vullen, dat wil zeggen 4stwee, 3d10, 4p6 en 5stwee, in totaal worden 20 elektronen toegevoegd. De 2 overige elektronen bevinden zich daarom in de volgende orbitaal: de 4d. De elektronenconfiguratie van zirkonium, [Zr] is dus: 1stwee2 sectwee2 Blz63stwee3p64stwee3d104p65stwee4dtwee.
Iridium
Iridium heeft een Z = 77, dus het heeft 37 extra elektronen in vergelijking met zirkonium. Beginnend bij [Cd], dat wil zeggen 1stwee2 sectwee2 Blz63stwee3p64stwee3d104p65stwee4d10, voeg 29 elektronen toe met de volgende orbitalen van het Moeller-diagram.
Nieuwe diagonalen tekenen, de nieuwe orbitalen zijn: 5p, 6s, 4f en 5d. Als we de eerste drie orbitalen volledig vullen, hebben we: 5p6, 6stwee en 4f14, om een totaal van 22 elektronen te geven.
Er ontbreken dus 7 elektronen, die in de 5d: 1s-orbitaal zitten.twee2 sectwee2 Blz63stwee3p64stwee3d104p65stwee4d105 p66stwee4f145 d7.
Het bovenstaande is de elektronenconfiguratie van iridium, [Go]. Merk op dat de 6s-orbitalentwee en 5d7 zijn vetgedrukt om aan te geven dat ze correct overeenkomen met de valentie-laag van dit metaal.
Uitzonderingen op het Moeller-diagram en de regel van Madelung
Er zijn veel elementen in het periodiek systeem die niet gehoorzamen aan wat zojuist is uitgelegd. Hun elektronenconfiguraties verschillen experimenteel van die welke om kwantumredenen zijn voorspeld..
Onder de elementen die deze verschillen vertonen zijn: chroom (Z = 24), koper (Z = 29), zilver (Z = 47), rhodium (Z = 45), cerium (Z = 58), niobium (Z = 41) en nog veel meer.
Uitzonderingen zijn zeer frequent bij het vullen van de d- en f-orbitalen. Chrome zou bijvoorbeeld een valentie-instelling van 4s moeten hebbentwee3d4 volgens het diagram van Moeller en de regel van Madelung, maar het is eigenlijk 4s13d5.
Ook, en tot slot, zou de zilvervalentie-instelling 5s moeten zijntwee4d9maar het is echt 5s14d10.
Referenties
- Gavira J. Vallejo M. (6 augustus 2013). Uitzonderingen op de regel van Madelung en het diagram van Moeller in de elektronische configuratie van chemische elementen. Hersteld van: triplenlace.com
- Mijn superklasse. (s.f.) Wat is elektronenconfiguratie? Hersteld van: misuperclase.com
- Wikipedia. (2018). Moeller diagram. Hersteld van: es.wikipedia.org
- Dummy's. (2018). Hoe elektronen weer te geven in een energieniveaudiagram. Hersteld van: dummies.com
- Schip R. (2016). Volgorde van het vullen van elektronenstaten. Hersteld van: hyperphysics.phy-astr.gsu.edu


Niemand heeft nog op dit artikel gereageerd.