
Wet van massa-actietoepassingen, voorbeelden
De wet van massa-actie legt de relatie vast tussen de actieve massa's van de reactanten en die van de producten, onder evenwichtsomstandigheden en in homogene systemen (oplossingen of gasfasen). Het is geformuleerd door de Noorse wetenschappers C.M. Guldberg en P. Waage, die erkenden dat evenwicht dynamisch is en niet statisch.
Waarom dynamisch? Omdat de snelheden van de voorwaartse en achterwaartse reacties gelijk zijn. Actieve massa's worden meestal uitgedrukt in mol / L (molariteit). Zo'n reactie kan als volgt worden geschreven: aA + bB <=> cC + dD. Voor het evenwicht dat in dit voorbeeld wordt genoemd, wordt de relatie tussen reactanten en producten geïllustreerd in de vergelijking in de onderstaande afbeelding.
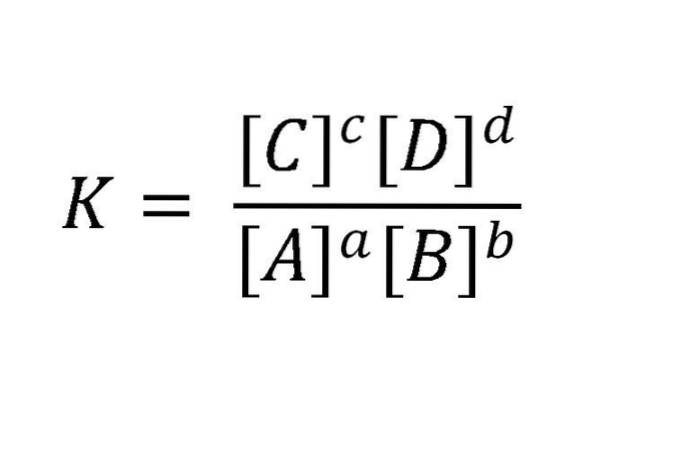
K is altijd constant, ongeacht de beginconcentraties van de stoffen, zolang de temperatuur niet varieert. Hier zijn A, B, C en D de reactanten en producten; terwijl a, b, c en d hun stoichiometrische coëfficiënten zijn.
De numerieke waarde van K is een karakteristieke constante voor elke reactie bij een bepaalde temperatuur. Dan is K wat de evenwichtsconstante wordt genoemd.
De notatie [] betekent dat in de wiskundige uitdrukking de concentraties verschijnen in eenheden van mol / L, verhoogd tot een macht gelijk aan de reactiecoëfficiënt.
Artikel index
- 1 Wat is de wet van massa-actie?
- 1.1 Betekenis van de evenwichtsconstante
- 2 Chemisch evenwicht
- 2.1 Evenwicht in heterogene systemen
- 2.2 Evenwichtsverplaatsingen
- 3 Principe van Le Chatelier
- 4 Toepassingen
- 5 Voorbeelden van de wet van massa-actie
- 6 De wet van massa-actie in de farmacologie
- 7 Beperkingen
- 8 referenties
Wat is de wet van massa-actie?
Zoals eerder vermeld, drukt de wet van massa-actie uit dat de snelheid van een bepaalde reactie recht evenredig is met het product van de concentraties van de reagenssoort, waarbij de concentratie van elke soort wordt verhoogd tot een vermogen dat gelijk is aan de stoichiometrische coëfficiënt in de chemische stof. vergelijking.
In die zin kan het beter worden verklaard door een omkeerbare reactie te hebben, waarvan de algemene vergelijking hieronder wordt geïllustreerd:
aA + bB ↔ cC + dD
Waar A en B staan voor de reactanten en de stoffen met de naam C en D staan voor de producten van de reactie. Evenzo vertegenwoordigen de waarden van a, b, c en d de stoichiometrische coëfficiënten van respectievelijk A, B, C en D..
Uitgaande van de vorige vergelijking wordt de eerder genoemde evenwichtsconstante verkregen, die wordt geïllustreerd als:
K = [C]c[D]d/[NAAR]naar[B]b
Waar de evenwichtsconstante K gelijk is aan een quotiënt, waarbij de teller bestaat uit de vermenigvuldiging van de concentraties van de producten (in evenwichtstoestand) verheven tot hun coëfficiënt in de gebalanceerde vergelijking en de noemer bestaat uit een vergelijkbare vermenigvuldiging maar onder de reactanten werden verhoogd tot de coëfficiënt die ermee gepaard gaat.
Betekenis van de evenwichtsconstante
Opgemerkt moet worden dat in de vergelijking om de evenwichtsconstante te berekenen, de concentraties van de soort in evenwicht moeten worden gebruikt, zolang er geen wijzigingen aan deze of aan de temperatuur van het systeem zijn..
Op dezelfde manier geeft de waarde van de evenwichtsconstante informatie over de richting die de voorkeur geniet bij een reactie bij evenwicht, dat wil zeggen, het onthult of de reactie gunstig is voor de reactanten of de producten..
Als de grootte van deze constante veel groter is dan eenheid (K "1), zal het evenwicht naar rechts verschuiven en de producten begunstigen; terwijl als de grootte van deze constante veel kleiner is dan eenheid (K" 1), het evenwicht zal naar links worden gekanteld en de reactanten begunstigen.
Hoewel volgens afspraak wordt aangegeven dat de stoffen aan de linkerkant van de pijl de reactanten zijn en die aan de rechterkant de producten zijn, wordt het feit dat de reactanten die uit de reactie komen in directe zin de producten in de reactie worden. omgekeerd en vice versa.
Chemisch evenwicht
Reacties bereiken vaak een evenwicht tussen de hoeveelheden uitgangsstoffen en die van de gevormde producten. Dit evenwicht kan bovendien verschuiven ten gunste van de toename of afname van een van de stoffen die aan de reactie deelnemen..
Een analoog feit doet zich voor bij de dissociatie van een opgeloste stof: tijdens een reactie kan het verdwijnen van de oorspronkelijke stoffen en de vorming van de producten experimenteel worden waargenomen met een variabele snelheid.
De reactiesnelheid is sterk afhankelijk van de temperatuur en in verschillende mate van de concentratie van de reactanten. In feite worden deze factoren vooral bestudeerd door middel van chemische kinetiek.
Dit evenwicht is echter niet statisch, maar komt voort uit het naast elkaar bestaan van een directe en een omgekeerde reactie..
Bij de directe reactie (->) worden de producten gevormd, terwijl bij de omgekeerde reactie (<-) estos vuelven a originar las sustancias iniciales.
Het bovenstaande vormt wat bekend staat als dynamisch evenwicht, zoals hierboven vermeld..
Evenwicht in heterogene systemen
In heterogene systemen - dat wil zeggen in systemen die door verschillende fasen worden gevormd - kunnen de concentraties van de vaste stoffen als constant worden beschouwd, waarbij de wiskundige uitdrukking voor K wordt weggelaten..
Dief3(s) <=> CaO ('s) + COtwee(g)
Aldus kan in het ontledingsevenwicht van calciumcarbonaat de concentratie en die van het resulterende oxide als constant worden beschouwd, ongeacht de massa..
Balans verschuift
De numerieke waarde van de evenwichtsconstante bepaalt of een reactie de vorming van producten bevordert. Als K groter is dan 1, zal het evenwichtssysteem een hogere concentratie aan producten hebben dan aan reactanten, en als K kleiner is dan 1, gebeurt het tegenovergestelde: in evenwicht zal er een grotere concentratie aan reactanten zijn dan aan producten..
Le Chatelier-principe
De invloed van variaties in concentratie, temperatuur en druk kan de reactiesnelheid veranderen.
Als bij een reactie bijvoorbeeld gasvormige producten worden gevormd, zorgt een toename van de druk over het systeem ervoor dat de reactie in de tegenovergestelde richting verloopt (naar de reactanten).
Over het algemeen zijn de anorganische reacties die plaatsvinden tussen ionen erg snel, terwijl de organische reacties veel lagere snelheden hebben..
Als bij een reactie warmte wordt geproduceerd, neigt een stijging van de buitentemperatuur deze in de tegenovergestelde richting te oriënteren, aangezien de omgekeerde reactie endotherm is (warmte absorbeert).
Evenzo, als een overmaat wordt veroorzaakt in een van de reagerende stoffen binnen een systeem in evenwicht, zullen de andere stoffen producten vormen om deze modificatie zoveel mogelijk te neutraliseren..
Als resultaat verschuift het evenwicht gunstiger in de ene of de andere richting door de reactiesnelheid te verhogen, zodanig dat de waarde van K constant blijft..
Al deze externe invloeden en de balansreactie om ze tegen te gaan, is wat bekend staat als het Le Chatelier-principe..
Toepassingen
Ondanks zijn enorme bruikbaarheid had deze wet, toen deze werd voorgesteld, niet de gewenste impact of relevantie in de wetenschappelijke gemeenschap.
Vanaf de twintigste eeuw kreeg het echter bekendheid dankzij het feit dat de Britse wetenschappers William Esson en Vernon Harcourt het enkele decennia na de afkondiging ervan weer oppakten..
De wet van massa-actie heeft in de loop van de tijd veel toepassingen gehad, waarvan er enkele hieronder worden vermeld:
- Omdat het is geformuleerd in termen van activiteiten in plaats van concentraties, is het nuttig om afwijkingen van het ideale gedrag van reactanten in een oplossing te bepalen, zolang het consistent is met de thermodynamica..
- Als een reactie het evenwicht nadert, kan de relatie tussen de nettosnelheid van de reactie en de momentane Gibbs-vrije energie van een reactie worden voorspeld..
- In combinatie met het gedetailleerde evenwichtsprincipe, geeft deze wet in algemene termen de resulterende waarden, volgens de thermodynamica, van de activiteiten en de constante in de evenwichtstoestand, evenals de relatie tussen deze en de resulterende snelheidsconstanten van reacties in de voorwaartse richting. en omgekeerde richtingen.
- Wanneer de reacties van het elementaire type zijn, verkrijgen we door deze wet toe te passen de juiste evenwichtsvergelijking voor een bepaalde chemische reactie en de uitdrukkingen van de snelheid ervan..
Voorbeelden van de wet van massa-actie
-Bij het bestuderen van een onomkeerbare reactie tussen ionen die in oplossing zijn gevonden, leidt de algemene uitdrukking van deze wet tot de Brönsted-Bjerrum-formulering, die de relatie vaststelt tussen de ionsterkte van de soort en de snelheidsconstante.
-Bij het analyseren van de reacties die worden uitgevoerd in verdunde ideale oplossingen of in een staat van gasvormige aggregatie, wordt de algemene uitdrukking van de oorspronkelijke wet (decennium van de jaren 80) verkregen.
-Omdat het universele kenmerken heeft, kan de algemene uitdrukking van deze wet worden gebruikt als onderdeel van de kinetiek in plaats van het te zien als onderdeel van de thermodynamica..
-Bij toepassing in de elektronica wordt deze wet gebruikt om te bepalen dat de vermenigvuldiging tussen de dichtheid van de gaten en de elektronen van een bepaald oppervlak een constante grootte heeft in de evenwichtstoestand, zelfs onafhankelijk van de dotering die aan het materiaal wordt toegevoerd..
-Het gebruik van deze wet om de dynamiek tussen roofdieren en prooi te beschrijven is algemeen bekend, ervan uitgaande dat de predatierelatie op de prooi een zekere verhouding vertoont met de relatie tussen roofdieren en prooi..
-Op het gebied van gezondheidsstudies kan deze wet zelfs worden toegepast om bepaalde factoren van menselijk gedrag te beschrijven, vanuit politiek en sociaal oogpunt..
De wet van massa-actie in de farmacologie
Ervan uitgaande dat D het medicijn is en R de receptor waarop het inwerkt, reageren beide om het DR-complex te veroorzaken, dat verantwoordelijk is voor het farmacologische effect:
K = [DR] / [D] [R]
K is de dissociatieconstante. Er is een directe reactie waarbij het medicijn inwerkt op de receptor, en een andere waarbij het DR-complex uiteenvalt in de oorspronkelijke verbindingen. Elke reactie heeft zijn eigen snelheid, die zichzelf alleen bij evenwicht gelijkstelt en voldoet aan K.
Als we de massawet letterlijk interpreteren: hoe hoger de concentratie van D, hoe hoger de concentratie van het gevormde DR-complex..
Totaal Rt-ontvangers hebben echter een fysieke limiet, dus er is geen onbeperkte hoeveelheid R voor alle beschikbare D. Evenzo hebben experimentele studies op het gebied van farmacologie de volgende beperkingen aan de massawet op dit gebied gevonden:
- Het veronderstelt dat de R-D-obligatie omkeerbaar is, terwijl dat in de meeste gevallen echt niet het geval is..
- De R-D-binding kan elk van de twee componenten (het medicijn of de receptor) structureel veranderen, een omstandigheid die geen rekening houdt met de massawet.
- Bovendien verbleekt de massawet bij reacties waarbij meerdere tussenpersonen ingrijpen bij de vorming van RD..
Beperkingen
De wet van massa-actie gaat ervan uit dat elke chemische reactie van een elementair type is; met andere woorden, dat de molecuulmassa hetzelfde is als de respectievelijke reactievolgorde voor elke betrokken soort.
Hier worden de stoichiometrische coëfficiënten a, b, c en d beschouwd als het aantal moleculen dat betrokken is bij het reactiemechanisme. In een globale reactie vallen deze echter niet noodzakelijk samen met hun volgorde..
Bijvoorbeeld voor de reactie aA + bB <=> cC + dD:
De snelheidsuitdrukking voor de directe en inverse reacties zijn:
k1= [A]naar[B]b
ktwee= [C]c[D]d
Dit geldt alleen voor elementaire reacties, aangezien voor globale reacties, hoewel de stoichiometrische coëfficiënten correct zijn, het niet altijd de reactieorden zijn. In het geval van de directe reactie kan dit laatste zijn:
k1= [A]w[B]z
In deze uitdrukking zouden w en z de echte reactieorden zijn voor soort A en B.
Referenties
- Jeffrey Aronson. (2015, 19 november). The Laws of Life: Guldberg en Waage's Law of Mass Action. Opgehaald op 10 mei 2018, van: cebm.net
- ScienceHQ. (2018). Wet van massa-actie. Opgehaald op 10 mei 2018, van: sciencehq.com
- askiitans. (2018). Wet van massa-actie en evenwichtsconstante. Opgehaald op 10 mei 2018, van: askiitians.com
- Salvat Encyclopedia of Sciences. (1968). Chemie. Deel 9, Salvat S.A. van edities Pamplona, Spanje. P 13-16.
- Walter J. Moore. (1963). Fysische chemie. In Thermodynamica en chemisch evenwicht. (Vierde ed.). Longmans. P 169.
- Alex Yartsev. (2018). De wet van massa-actie in de farmacodynamiek. Opgehaald op 10 mei 2018, van: derangedphysiology.com



Niemand heeft nog op dit artikel gereageerd.