
Dimethylamine ((CH3) 2NH) structuur, eigenschappen, gebruik, risico's

De dimethylamine is een organische verbinding gevormd door twee methylgroepen -CH3 gehecht aan een -NH-groep. De chemische formule is (CH3tweeNH. Het is een kleurloos gas. Wanneer het in lage concentraties in de lucht is, wordt een visgeur waargenomen. Als het echter in hoge concentratie is, ruikt het naar ammoniak NH3.
Dimethylamine komt voor in planten en dieren. Aangenomen wordt dat het bij mensen het gevolg is van de afbraak van bepaalde enzymen, maar ook van de inname van voedsel, zoals vis. Als dimethylaminegas in water oplost, vormt het sterk alkalische en corrosieve oplossingen.
Het heeft verschillende industriële toepassingen, zoals het maken van oplosmiddelen, het versnellen van de vulkanisatie van rubber, het tegengaan van corrosie van leidingen, het maken van zeep, het maken van kleurstoffen en het absorberen van zure gassen in bepaalde processen..
Dimethylamine is een licht ontvlambaar gas. Containers mogen niet worden blootgesteld aan hitte of vuur, aangezien ze kunnen ontploffen. Bovendien zijn de dampen irriterend voor de ogen, de huid en de luchtwegen..
Het is een verbinding die mogelijk deel uitmaakt van atmosferische aerosolen, dat wil zeggen, zeer fijne druppeltjes die in de atmosfeer worden aangetroffen.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Vlampunt
- 3.6 Zelfontbrandingstemperatuur
- 3.7 Dichtheid
- 3.8 Oplosbaarheid
- 3,9 pH
- 3.10 Dissociatieconstante
- 3.11 Chemische eigenschappen
- 3.12 Overige eigenschappen
- 3.13 Biochemische reacties
- 4 Verkrijgen
- 5 Aanwezigheid in de natuur
- 5.1 Patiënten met een teveel aan dimethylamine
- 6 toepassingen
- 7 Risico's
- 8 Invloed van DMA op de atmosfeer
- 9 referenties
Structuur
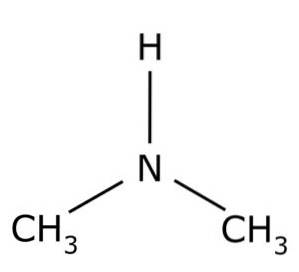
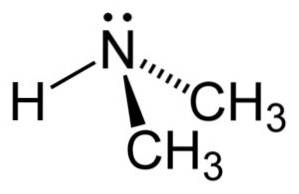
Dimethylamine is een secundair alifatisch amine. Dit betekent dat de stikstofsubstituenten (N) alifatisch zijn (-CH3), wat betekent dat ze niet aromatisch zijn, en dat het er twee zijn. Daarom zijn het twee methyls -CH3 gehecht aan stikstof, dat ook een waterstof (H) heeft.
In het dimethylaminemolecuul heeft stikstof (N) een paar vrije elektronen, dat wil zeggen een paar elektronen die niet aan een ander atoom zijn gebonden..
Nomenclatuur
- Dimethylamine
- N, N-dimethylamine
- N-methylmethanamine
- DMA (afkorting voor Di-Methyl-Amine).
Eigendommen
Fysieke toestand
Kleurloos gas.
Molecuulgewicht
45,08 g / mol
Smeltpunt
-93 ºC
Kookpunt
7,3 ºC
Vlampunt
-6,69 ºC (methode met gesloten kroes).
Zelfontbranding temperatuur
400 ° C
Dichtheid
Vloeistof = 0,6804 g / cm3 bij 0 ºC.
Damp = 1,6 (relatieve dichtheid t.o.v. lucht, lucht = 1).
Oplosbaarheid
Zeer goed oplosbaar in water: 163 g / 100 g water bij 40 ° C. Oplosbaar in ethanol en ethylether.
pH
Waterige dimethylamine-oplossingen zijn sterk alkalisch.
Dissociatieconstante
Kb = 5,4 x 10-4
pKnaar geconjugeerd zuur = 10,732 bij 25 ° C Het geconjugeerde zuur is het dimethylammoniumion: (CH3) NHtwee+
Chemische eigenschappen
Vloeibaar dimethylamine kan sommige kunststoffen, rubbers en coatings aantasten.
Wanneer opgelost in water, neemt het vrije elektronenpaar (N) van stikstof een proton aan (H.+) uit het water, waardoor een OH vrij blijft-, dus het vormt zeer alkalische en corrosieve oplossingen:
Dimethylamine + water → Dimethylammoniumion + hydroxylion
(CH3tweeNH + HtweeO → (CH3tweeNHtwee+ + Oh-
Met salpeterzuur krijg je een nitraatzout, dat wil zeggen dimethylammoniumnitraat:
Dimethylamine + salpeterzuur → Dimethylammoniumnitraat
(CH3tweeNH + HNO3 → (CH3tweeNHtwee+NIET3-
Andere eigenschappen
In lage concentratie in de lucht heeft het een visachtige geur, terwijl het in hoge concentraties ruikt naar ammoniak (NH3.
Biochemische reacties
In het lichaam kan dimethylamine nitrosatie ondergaan onder zwak zure omstandigheden om dimethylnitrosamine een kankerverwekkende verbinding te geven (CH3tweeN-NO.
De vorming van dimethylnitrosamine vindt plaats uit dimethylamine en nitriet (natriumnitriet) in de maag (bij pH 5-6) door de werking van bacteriën in het maagdarmkanaal. Natriumnitriet is aanwezig in sommige voedingsmiddelen.
Dimethylamine + natriumnitriet → Dimethylnitrosamine + natriumhydroxide
(CH3tweeNH + NaNOtwee → (CH3tweeN-NO + NaOH
Het verkrijgen van
Dimethylamine wordt commercieel bereid door methanol (CH3OH) met ammoniak (NH3) bij 350-450 ° C in aanwezigheid van een silica-alumina katalysator (SiOtwee/Naar detweeOF3.
2 CH3OH + NH3 → (CH3tweeNH + 2 HtweeOF
Omdat ook monomethylamine en trimethylamine worden geproduceerd, wordt de zuivering uitgevoerd in een reeks van vier tot vijf destillatiekolommen..
Aanwezigheid in de natuur
Dimethylamine komt voor in planten en dieren. Het is ook van nature en overvloedig aanwezig in menselijke urine.
Geschat wordt dat zijn aanwezigheid bij mensen te wijten is aan het feit dat het wordt geproduceerd door bepaalde soorten darmbacteriën uit sommige verbindingen die in voedsel worden aangetroffen.
Sommige van deze verbindingen zijn choline (een verbinding die wordt geassocieerd met de groep van B-vitamines) en trimethylamineoxide. Er wordt ook aangenomen dat het afkomstig is van een enzym dat stikstofmonoxide (NO) remt dat in het lichaam wordt gevormd..
Bepaalde informatiebronnen geven aan dat de toename van dimethylamine in de urine wordt veroorzaakt door de opname van vis en zeevruchten, waarbij de hoogste waarden worden verkregen wanneer inktvis, heek, sardines, zwaardvis, kabeljauw, wijting en rog worden gegeten..

Patiënten met een teveel aan dimethylamine
Dimethylamine wordt beschouwd als een uremisch toxine, dat wil zeggen een stof die schade kan veroorzaken als de concentratie in de urine te hoog is. In feite zijn zeer hoge dimethylaminespiegels waargenomen bij patiënten met terminale nierziekte..
Aangenomen wordt dat er bij deze patiënten mogelijk een overbevolking is van darmbacteriën die het zouden kunnen produceren.
Toepassingen
Dimethylamine of DMA wordt gebruikt om:
- Bereiding van andere verbindingen.
- Productie van de oplosmiddelen dimethylformamide en dimethylaceetamide.
- Versnel de vulkanisatie van bepaalde rubbers.
- Verwijder haar van huiden tijdens het bruinen.
- Werk als een antioxidant voor oplosmiddelen.
- Dienen als een mineraal flotatiemiddel.
- Remt corrosie en als aangroeiwerend middel voor leidingen.
- Functioneren als een oppervlakteactieve stof.
- Maak zeep en wasmiddelen.
- Handel als een textielchemicus.
- Functioneren als antiklopmiddel in brandstoffen en als stabilisator voor benzine.
- Bereid kleurstoffen voor.
- Absorbeer zure gassen.
- Dienen als drijfgas voor pesticiden en raketten.
- Maak deel uit van middelen voor waterbehandeling.
- Werk als een fungicide in agrochemische producten.
- Stopgezet gebruik, zoals het aantrekken en doden van snuitkevers of insecten die katoen aantasten.


Risico's
Dampen van dimethylamine zijn irriterend voor de huid, ogen en luchtwegen..
Als het in vloeibare vorm in contact komt met de huid, kan het bevriezing en chemische brandwonden veroorzaken. De inademing heeft nadelige gevolgen voor de gezondheid.
DMA-gas is corrosief en kan corrosieve waterige oplossingen vormen. Uw waterige oplossingen kunnen ontvlambaar worden, tenzij ze goed worden verdund..
Dimethylamine in gasvorm ontbrandt gemakkelijk met vorming van giftige dampen van stikstofoxides (NOX.
Als de container met dit gas wordt blootgesteld aan vuur of intense hitte, kan deze ontploffen..
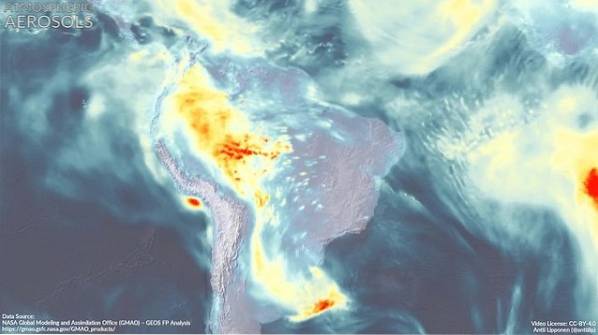
Invloed van DMA op de atmosfeer
De atmosferische aerosol (zeer kleine druppeltjes van een mengsel van natuurlijke verbindingen en / of verontreinigende stoffen in de atmosfeer) heeft een grote invloed op het mondiale klimaat en op de luchtkwaliteit in de verschillende regio's van de wereld..
De vorming van de nieuwe aerosoldeeltjes is nog niet volledig begrepen.
Er wordt geschat dat dimethylamine samen met andere verbindingen deelneemt aan de vorming van deze deeltjes, wat lijkt af te hangen van het feit dat er sterke emissies van DMA in het gebied zijn..
Zo is er in industriegebieden een hogere concentratie dan in agrarische gebieden, en dit kan invloed hebben op de manier waarop de KRW participeert..
Het is opmerkelijk dat, volgens sommige wetenschappers, het verbranden van plantaardig materiaal dat glyfosaat bevat (een van de meest gebruikte herbiciden ter wereld), kan leiden tot de vorming van dimethylamine..
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Dimethylamine. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Vierde druk. John Wiley & Sons.
- Morrison, R.T. en Boyd, R.N. (2002). Organische chemie. 6e editie. Prentice-Hall.
- Windholz, M. et al. (redactie) (1983). De Merck Index. Een encyclopedie van chemicaliën, medicijnen en biologische producten. Tiende editie. Merck & CO., Inc.
- Abramowitz, M.K. et al. (2010). De pathofysiologie van uremie. Alifatische aminen. Bij chronische nierziekte, dialyse en transplantatie (derde editie). Opgehaald van sciencedirect.com.
- Li, H. et al. (2019). Invloed van atmosferische omstandigheden op op zwavelzuur-dimethylamine-ammoniak gebaseerde nieuwe deeltjesvorming. Chemosphere 2019; 245: 125554. Opgehaald van ncbi.nlm.nih.gov.
- Mackie, J.C. en Kennedy, E.M. (2019). Pyrolyse van glyfosaat en zijn giftige producten. Environ. Sci Technol. 2019: 53 (23): 13742-13747. Opgehaald van ncbi.nlm.nih.gov.


Niemand heeft nog op dit artikel gereageerd.