
Zwaveldioxide (SO2) structuur, eigenschappen, gebruik, risico's

De zwaveldioxide is een gasvormige anorganische verbinding gevormd door zwavel (S) en zuurstof (O), de chemische formule is SOtwee. Het is een kleurloos gas met een irriterende en verstikkende geur. Bovendien is het oplosbaar in water en vormt het zure oplossingen. Vulkanen verdrijven het tijdens uitbarstingen in de atmosfeer.
Het maakt deel uit van de biologische en geochemische cyclus van zwavel, maar het wordt in grote hoeveelheden geproduceerd door bepaalde menselijke activiteiten zoals olieraffinage en het verbranden van fossiele brandstoffen (bijvoorbeeld kolen of diesel).

De SOtwee het is een reductiemiddel dat ervoor zorgt dat de papierpulp wit blijft na het bleken met andere verbindingen. Het dient ook om sporen van chloor te verwijderen uit water dat met deze chemische stof is behandeld.
Het wordt gebruikt om sommige soorten voedsel te bewaren, om containers te desinfecteren waarin de fermentatie van druivensap wordt geproduceerd om wijn of gerst te produceren om bier van te maken..
Het wordt ook gebruikt als fungicide in de landbouw, om zwavelzuur te verkrijgen, als oplosmiddel en als tussenproduct bij chemische reacties..
De SOtwee aanwezig in de atmosfeer is schadelijk voor veel planten, in water tast het vissen aan en is het ook een van degenen die verantwoordelijk zijn voor "zure regen" die door mensen gemaakte materialen aantast.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3,7 pH
- 3.8 Chemische eigenschappen
- 3.9 Waterige oplossingen van SO2
- 3.10 Overige eigenschappen
- 4 Verkrijgen
- 5 Aanwezigheid in de natuur
- 6 toepassingen
- 6.1 Bij de productie van zwavelzuur
- 6.2 In de verwerkte voedingsmiddelenindustrie
- 6.3 Als oplosmiddel en reagens
- 6.4 Als reductiemiddel
- 6.5 In verschillende toepassingen
- 7 Effecten van endogene SO2
- 8 Risico's
- 8.1 Ecotoxiciteit
- 8.2 Effecten van inname met voedsel
- 9 referenties
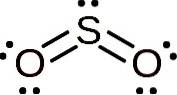
Structuur
Het zwaveldioxidemolecuul is symmetrisch en vormt een hoek. De hoek is te wijten aan de SOtwee Het heeft een paar solitaire elektronen, dat wil zeggen elektronen die geen binding vormen met een atoom, maar vrij zijn.
Nomenclatuur
- Zwaveldioxide
- Zwavelanhydride
- Zwavelig oxide.
Eigendommen
Fysieke toestand
Kleurloos gas.
Molecuulgewicht
64,07 g / mol
Smeltpunt
-75,5 ºC
Kookpunt
-10,05 ºC
Dichtheid
Gas: 2,26 bij 0 ° C (ten opzichte van lucht, d.w.z. luchtdichtheid = 1). Dit betekent dat het zwaarder is dan lucht..
Vloeistof: 1,4 tot -10 ° C (in verhouding tot water, d.w.z. dichtheid van water = 1).
Oplosbaarheid
Oplosbaar in water: 17,7% bij 0 ° C; 11,9% bij 15 ° C; 8,5% bij 25 ° C; 6,4% bij 35 ° C.
Oplosbaar in ethanol, diethylether, aceton en chloroform. Het is minder oplosbaar in niet-polaire oplosmiddelen.
pH
Waterige oplossingen van SOtwee ze zijn zuur.
Chemische eigenschappen
De SOtwee het is een krachtig reductie- en oxidatiemiddel. In aanwezigheid van lucht en een katalysator oxideert het tot SO3.
SWtwee + OFtwee → ZO3
De eenzame elektronenparen zorgen er soms voor dat het zich gedraagt als een Lewis-base, met andere woorden, het kan reageren met verbindingen waarbij een atoom elektronen mist..
Als het OStwee het heeft de vorm van een gas en tast ijzer, staal, koper-nikkel of nikkel-chroom-ijzerlegeringen niet aan. Als het zich echter in vloeibare of natte toestand bevindt, veroorzaakt het corrosie van deze metalen..
De SOtwee vloeistof met 0,2% water of meer veroorzaakt sterke corrosie van ijzer, messing en koper. Het is corrosief voor aluminium.
Als het vloeibaar is, kan het ook sommige kunststoffen, rubbers en coatings aantasten.
Waterige SO-oplossingentwee
De SOtwee het is zeer oplosbaar in water. Lang werd aangenomen dat het in water zwavelig zuur H vormttweeSW3, maar het bestaan van dit zuur is niet bewezen.
In OS-oplossingentwee in water treden de volgende evenwichten op:
SWtwee + H.tweeO ⇔ ZOtwee.H.tweeOF
SWtwee.H.tweeO ⇔ HSO3- + H.3OF+
HSO3- + H.tweeO ⇔ ZO3twee- + H.3OF+
Waar HSO3- is het bisulfietion en SO3twee- is het sulfietion. Het sulfietion SO3twee- treedt voornamelijk op wanneer een alkali wordt toegevoegd aan de SO-oplossingtwee.
Waterige oplossingen van SOtwee hebben reducerende eigenschappen, vooral als ze alkalisch zijn.
Andere eigenschappen
- Het is extreem hittebestendig, zelfs tot 2000 ° C.
- Het is niet brandbaar.
Het verkrijgen van
De SOtwee Het wordt verkregen door verbranding van zwavel (S) in de lucht, hoewel er ook kleine hoeveelheden SO worden gevormd3.
S + Otwee → ZOtwee
Het kan ook worden geproduceerd door verschillende sulfiden in de lucht te verhitten, pyrietmineralen en sulfidenhoudende mineralen te verbranden..
In het geval van ijzerpyriet worden na oxidatie ijzeroxide (iii) en SO verkregen.twee
4 FeStwee + 11 Otwee → 2 FetweeOF3 + 8 ZOtwee
Aanwezigheid in de natuur
De SOtwee Het komt vrij in de atmosfeer door de activiteit van vulkanen (9%), maar het wordt ook veroorzaakt door andere natuurlijke activiteiten (15%) en door menselijk handelen (76%).
Explosieve vulkaanuitbarstingen veroorzaken aanzienlijke jaarlijkse schommelingen of variaties in SOtwee in de atmosfeer. Geschat wordt dat 25% van de SOtwee uitgestoten door vulkanen wordt weggespoeld door regen voordat het de stratosfeer bereikt.
Natuurlijke bronnen zijn de meest voorkomende en zijn te wijten aan de biologische cyclus van zwavel.
In stedelijke en industriële gebieden overheersen menselijke bronnen. De belangrijkste menselijke activiteit die het produceert, is het verbranden van fossiele brandstoffen, zoals steenkool, benzine en diesel. Andere menselijke bronnen zijn olieraffinaderijen, chemische fabrieken en gasproductie.

Bij zoogdieren wordt het endogeen gegenereerd, dat wil zeggen in het lichaam van dieren en mensen als gevolg van het metabolisme van zwavelhoudende aminozuren (S), vooral L-cysteïne..
Toepassingen
Bij de productie van zwavelzuur
Een van de belangrijkste toepassingen van het besturingssysteemtwee is in het verkrijgen van zwavelzuur HtweeSW4.
2 ZOtwee + 2 uurtweeO + Otwee → 2 H.tweeSW4
In de verwerkte voedingsmiddelenindustrie
Zwaveldioxide wordt gebruikt als conserveermiddel en stabilisator voor voedsel, als vochtregulerend middel en als smaak- en textuurmodificator in bepaalde eetbare producten..
Het wordt ook gebruikt om apparatuur te desinfecteren die in contact komt met voedingsmiddelen, fermentatieapparatuur, zoals die in brouwerijen en wijnmakerijen, voedselcontainers, enz..
Het maakt het mogelijk om groenten en fruit te bewaren, verlengt de houdbaarheid, voorkomt kleur- en smaakverlies en helpt bij het vasthouden van vitamine C (ascorbinezuur) en carotenen (voorlopers van vitamine A).

Het wordt gebruikt om wijn te conserveren, omdat het bacteriën, schimmels en ongewenste gisten vernietigt. Het wordt ook gebruikt om de vorming van nitrosaminen in bier te steriliseren en te voorkomen..

Het wordt ook gebruikt om maïskorrels te weken, bietsuiker witter te maken en als antimicrobieel middel bij de vervaardiging van maïssiroop met een hoog fructosegehalte..
Als oplosmiddel en reagens
Het wordt veel gebruikt als een niet-waterig oplosmiddel. Hoewel het geen ioniserend oplosmiddel is, is het wel bruikbaar als protonenvrij oplosmiddel voor bepaalde analytische toepassingen en chemische reacties..
Het wordt gebruikt als oplosmiddel en reagens bij organische synthese, als tussenproduct bij de productie van andere verbindingen zoals chloordioxide, acetylchloride en bij de sulfonering van oliën..
Als reductiemiddel
Het wordt gebruikt als een reductiemiddel, ondanks dat het niet zo sterk is, en in een alkalische oplossing wordt het sulfietion gevormd, dat een meer energetisch reductiemiddel is..
In verschillende toepassingen
De SOtwee wordt ook gebruikt:
- In de landbouw als fungicide en conserveermiddel voor druiven na de oogst.
- Om hydrosulfieten te maken.
- Voor het bleken van houtpulp en papier, omdat het de pulp na het bleken met waterstofperoxide H laat stabiliserentweeOFtweede SOtwee handelt door het vernietigen van de HtweeOFtwee rest en dus behoud de helderheid van de pulp, aangezien de H.tweeOFtwee kan een omkering van de helderheid veroorzaken.
- Voor het bleken van textielvezels en rieten artikelen.
- Om water te behandelen omdat het het resterende chloor verwijdert dat overblijft na de chlorering van drinkwater, afvalwater of industrieel water.
- Bij de raffinage van mineralen en metalen, als reductiemiddel voor ijzer tijdens minerale verwerking.
- Bij aardolieraffinage om zuurstof op te vangen en corrosie te vertragen, en als extractieoplosmiddel.
- Als antioxidant.
- Als alkalische neutralisator bij de glasproductie.
- In lithiumbatterijen als oxidatiemiddel.
Effecten van het besturingssysteemtwee endogeen
Bepaalde onderzoeken hebben aangetoond dat SOtwee endogeen of geproduceerd door het lichaam zelf heeft een gunstig effect op het cardiovasculaire systeem, inclusief de regulatie van de hartfunctie en de ontspanning van bloedvaten.
Wanneer SO in het lichaam wordt geproduceerdtwee wordt zijn derivaten bisulfiet HSO3- en sulfiet SO3twee-, die een vaso-relaxerend effect hebben op de slagaders.
De SOtwee verlaagt endogeen hypertensie, voorkomt de ontwikkeling van atherosclerose en beschermt het hart tegen schade aan het myocardium. Het heeft ook een antioxiderende werking, remt ontstekingen en apoptose (geprogrammeerde celdood).
Om deze redenen wordt gedacht dat het een mogelijke nieuwe therapie voor hart- en vaatziekten kan zijn..
Risico's
- Blootstelling aan SOtwee gasvormig kan leiden tot brandwonden aan ogen, huid, keel en slijmvliezen, schade aan luchtwegen en longen.
- Sommige onderzoeken melden dat het een potentieel risico heeft op schade aan het genetisch materiaal van zoogdier- en menselijke cellen.
- Het is bijtend. Het is niet brandbaar.
Ecotoxiciteit
Zwaveldioxide is het meest voorkomende vervuilende gas in de atmosfeer, vooral in stedelijke en industriële gebieden..
Zijn aanwezigheid in de atmosfeer draagt bij aan de zogenaamde "zure regen" die schadelijk is voor in het water levende organismen, vissen, terrestrische vegetatie en corrosie van door mensen gemaakte materialen..

De SOtwee het is giftig voor vissen. Groene planten zijn extreem gevoelig voor SOtwee sfeervol. Alfalfa, katoen, gerst en tarwe worden beschadigd bij lage milieuniveaus, terwijl aardappelen, uien en maïs veel resistenter zijn.
Effecten van inname met voedsel
Hoewel het onschadelijk is voor gezonde mensen, wordt SOtwee kan astma veroorzaken bij gevoelige mensen die het met voedsel innemen.
De voedingsmiddelen die het meestal bevatten, zijn gedroogd fruit, kunstmatige frisdranken en alcoholische dranken.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Zwaveldioxide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Huang, Y. et al. (2016). Endogene zwaveldioxide: een nieuw lid van de Gasotransmitter-familie in het cardiovasculaire systeem. Oxid Med Cell Longev. 2016; 2016: 8961951. Opgehaald van ncbi.nlm.nih.gov.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Windholz, M. et al. (redactie) (1983). De Merck Index. Een encyclopedie van chemicaliën, medicijnen en biologische producten. Tiende editie. Merck & CO., Inc.
- Pan, X. (2011). Zwaveloxiden: bronnen, blootstelling en gezondheidseffecten. Gezondheidseffecten van zwaveloxiden. In Encyclopedia of Environmental Health. Opgehaald van sciencedirect.com.
- Tricker, R. en Tricker, S. (1999). Verontreinigende stoffen en verontreinigende stoffen. Zwaveldioxide. In omgevingsvereisten voor elektromechanische en elektronische apparatuur. Opgehaald van sciencedirect.com.
- Bleam, W. (2017). Chemie op zuurbasis. Zwaveloxiden. In Soil and Environmental Chemistry (Second Edition). Opgehaald van sciencedirect.com.
- Freedman, B.J. (1980). Zwaveldioxide in voedingsmiddelen en dranken: het gebruik ervan als conserveermiddel en het effect op astma. Br J Dis Chest. 1980; 14 (2): 128-34. Opgehaald van ncbi.nlm.nih.gov.
- Craig, K. (2018). Een overzicht van de chemie, het gebruik van pesticiden en het lot van zwaveldioxide in het milieu, zoals gebruikt in Californië. In recensies van milieuverontreiniging en toxicologie. Volume 246. Hersteld van link.springer.com.



Niemand heeft nog op dit artikel gereageerd.