
Wat zijn energiesubniveaus en hoe worden ze weergegeven?

De energie subniveaus in het atoom zijn ze de manier waarop de elektronen zijn georganiseerd in de elektronenschillen, hun verdeling in het molecuul of atoom. Deze energiesubniveaus worden orbitalen genoemd..
De organisatie van elektronen in subniveaus is wat de chemische combinaties van verschillende atomen mogelijk maakt en ook hun positie binnen het periodiek systeem der elementen bepaalt..
Elektronen worden op een bepaalde manier in de elektronenschillen van het atoom gerangschikt door een combinatie van kwantumtoestanden. Op het moment dat een van deze toestanden wordt ingenomen door een elektron, moeten de andere elektronen zich in een andere toestand bevinden.
Artikel index
- 1. Inleiding
- 2 Locatie in het periodiek systeem der elementen
- 3 Locatie van het elektron in de orbitalen
- 4 Speciale elektronische configuraties
- 5 referenties
Invoering
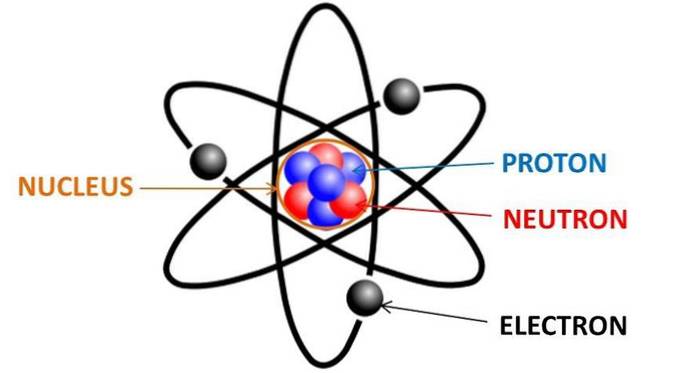
Elk chemisch element in het periodiek systeem bestaat uit atomen, die op hun beurt weer bestaan uit neutronen, protonen en elektronen. Elektronen zijn negatief geladen deeltjes die worden gevonden rond de kern van een atoom, verdeeld in de orbitalen van de elektronen.
Elektronenorbitalen zijn het volume van de ruimte waar een elektron een kans van 95% heeft om elkaar te ontmoeten. Er zijn verschillende soorten orbitalen, met verschillende vormen. In elke orbitaal kunnen maximaal twee elektronen worden geplaatst. De eerste orbitaal van een atoom is waar de kans het grootst is om elektronen te vinden.
De orbitalen worden aangeduid met de letters s, p, d en f, dat wil zeggen Sharp, Principle, Diffuse en Fundamental, en ze combineren wanneer atomen samenkomen om een groter molecuul te vormen. In elke laag van het atoom bevinden zich deze combinaties van orbitalen.
In laag 1 van het atoom zijn er bijvoorbeeld de S-orbitalen, in laag 2 zijn er S- en P-orbitalen, in laag 3 van het atoom zijn er S-, P- en D-orbitalen en tenslotte in laag 4 van het atoom zijn er allemaal de S-, P-, D- en F-orbitalen.
Ook in de orbitalen vinden we verschillende subniveaus, die op hun beurt weer meer elektronen kunnen opslaan. Orbitalen op verschillende energieniveaus lijken op elkaar, maar bezetten verschillende gebieden in de ruimte..
De eerste orbitaal en de tweede orbitaal hebben dezelfde kenmerken als een S-orbitaal, ze hebben radiale knooppunten, ze hebben een grotere kans op sferisch volume en ze kunnen maar twee elektronen bevatten. Ze bevinden zich echter op verschillende energieniveaus en bezetten dus verschillende ruimtes rond de kern..
Locatie op het periodiek systeem der elementen
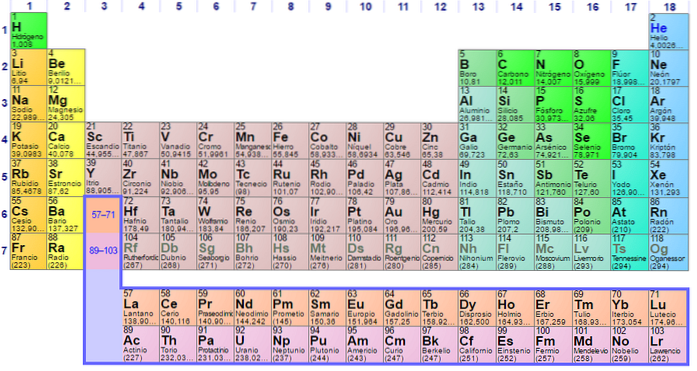
Elk van de elektronische configuraties van de elementen is uniek en daarom bepalen ze hun positie in het periodiek systeem der elementen. Deze positie wordt bepaald door de periode van elk element en zijn atoomnummer door het aantal elektronen dat het atoom van het element heeft..
Het is dus van cruciaal belang om het periodiek systeem te gebruiken om de configuratie van elektronen in atomen te bepalen. De elementen zijn als volgt ingedeeld in groepen op basis van hun elektronische configuraties:
Elke orbitaal wordt weergegeven in specifieke blokken binnen het periodiek systeem der elementen. Het blok van S-orbitalen is bijvoorbeeld het gebied van de alkalimetalen, de eerste groep in de tabel en waar zes elementen worden gevonden Lithium (Li), Rubidium (Rb), Kalium (K), Natrium (Na), Francium ( Fr) en cesium (Cs) en ook waterstof (H), dat geen metaal is, maar een gas.
Deze groep elementen heeft een elektron, dat gemakkelijk verloren gaat om een positief geladen ion te vormen. Ze zijn de meest actieve metalen en de meest reactieve.
Waterstof is in dit geval een gas, maar het valt binnen groep 1 van het periodiek systeem der elementen omdat het ook maar één elektron heeft. Waterstof kan ionen vormen met een enkele positieve lading, maar het verwijderen van zijn enkele elektron vereist veel meer energie dan het verwijderen van elektronen uit de andere alkalimetalen. Bij het vormen van verbindingen genereert waterstof gewoonlijk covalente bindingen.
Onder extreem hoge drukken wordt waterstof echter metaalachtig en gedraagt het zich als de rest van de elementen in zijn groep. Dit gebeurt bijvoorbeeld in de kern van de planeet Jupiter.
Groep 2 komt overeen met de aardalkalimetalen, aangezien hun oxiden alkalische eigenschappen hebben. Onder de elementen van deze groep vinden we Magnesium (Mg) en Calcium (Ca). Hun orbitalen behoren ook tot het S-niveau.
De overgangsmetalen, die overeenkomen met de groepen 3 tot 12 in het periodiek systeem, hebben orbitalen van het D-type..
De elementen die van groep 13 tot 18 in de tabel gaan, komen overeen met P-orbitalen. En tenslotte hebben de elementen die bekend staan als lanthaniden en actiniden orbitalen genaamd F.
Elektronenlocatie in orbitalen
Elektronen worden gevonden in de orbitalen van het atoom als een manier om energie te verlagen. Daarom, als ze proberen de energie te verhogen, zullen de elektronen de belangrijkste orbitale niveaus vullen, weg van de kern van het atoom..
Er moet rekening mee worden gehouden dat elektronen een intrinsieke eigenschap hebben die bekend staat als spin. Dit is een kwantumconcept dat onder andere de spin van het elektron binnen de orbitaal bepaalt. Wat is essentieel om uw positie in de energie-subniveaus te bepalen.
De regels die de positie van de elektronen in de orbitalen van het atoom bepalen, zijn de volgende:
- Aufbau's principe: elektronen komen als eerste de orbitalen met de laagste energie binnen. Dit principe is gebaseerd op diagrammen van de energieniveaus van bepaalde atomen.
- Pauli-uitsluitingsprincipe: een atoombaan kan ten minste twee elektronen beschrijven. Dit betekent dat slechts twee elektronen met verschillende elektronenspin een atomaire orbitaal kunnen bezetten..
Dit impliceert dat een atomaire orbitaal een energietoestand is.
- Hund's Rule: wanneer de elektronen orbitalen van dezelfde energie bezetten, zullen de elektronen de eerste lege orbitalen binnengaan. Dit betekent dat elektronen de voorkeur geven aan parallelle spins in afzonderlijke banen van de energiesubniveaus..
De elektronen vullen alle orbitalen in de subniveaus voordat ze tegengestelde spins tegenkomen.
Speciale elektronische configuraties
Er zijn ook atomen met speciale gevallen van energiesubniveaus. Wanneer twee elektronen dezelfde baan bezetten, moeten ze niet alleen verschillende spins hebben (zoals aangegeven door het Pauli Exclusion-principe), maar de koppeling van de elektronen verhoogt de energie ook iets..
In het geval van energie-subniveaus verminderen een halfvol en een volledig volledig subniveau de energie van het atoom. Dit leidt ertoe dat het atoom een grotere stabiliteit heeft.
Referenties
- Elektronen configuratie. Opgehaald van Wikipedia.com.
- Elektronische configuraties Intro. Opgehaald van chem.libretexts.org.
- Orbitalen en obligaties. Opgehaald van chem.fsu.edu.
- Periodiek systeem, belangrijkste groepselementen. Opgehaald van newworldencyclopedia.org.
- Electro configuratie principes. Opgehaald van sartep.com.
- Elektronische configuratie van elementen. Opgehaald van science.uwaterloo.ca.
- Electron Spin. Hersteld van hyperphysics.phy-astr.gsu.edu.


Niemand heeft nog op dit artikel gereageerd.