
Biogenetische elementen Kenmerken, typen en functies

Ze worden genoemd biogenetische elementen die atomen waaruit levende materie bestaat. Etymologisch komt de term vandaan bio, wat in het Grieks "leven" betekent; Y Genesis, wat "oorsprong" betekent. Van alle bekende elementen zijn er slechts een dertigtal onmisbaar..
Op het laagste organisatieniveau bestaat materie uit kleine deeltjes die atomen worden genoemd. Elk atoom bestaat uit protonen en neutronen in de kern en een aantal elektronen eromheen. Deze bestanddelen bepalen de eigenschappen van de elementen.
Ze hebben structurele functies, omdat ze de fundamentele bestanddelen zijn van biologische moleculen (eiwitten, koolhydraten, lipiden en nucleïnezuren) of aanwezig zijn in hun ionische vorm en fungeren als een elektrolyt. Ze hebben ook specifieke functies, zoals het bevorderen van spiercontractie of aanwezig zijn op de actieve plaats van een enzym.
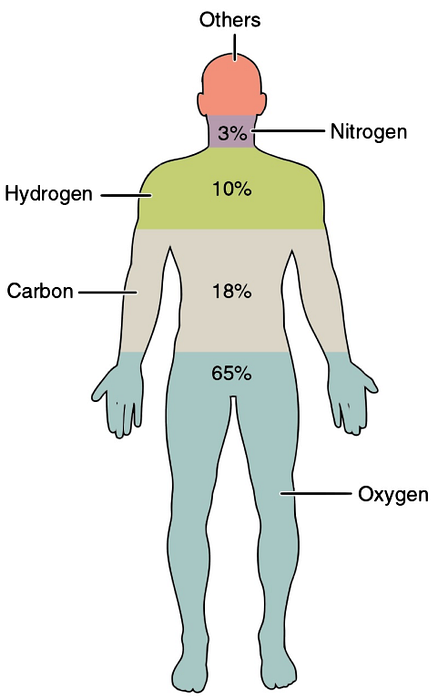
Alle biogenetische elementen zijn essentieel, en als er een zouden ontbreken, zou het fenomeen leven niet kunnen voorkomen. De belangrijkste biogenetische elementen die het meest voorkomen in levende materie zijn koolstof, waterstof, stikstof, zuurstof, fosfor en zwavel..
Artikel index
- 1 Kenmerken
- 1.1 Covalente bindingen
- 1.2 Mogelijkheid om enkele, dubbele en drievoudige bindingen te vormen
- 2 Classificatie
- 2.1 Primaire elementen
- 2.2 Secundaire elementen
- 2.3 Spoorelementen
- 3 functies
- 3.1 Koolstof
- 3.2 Zuurstof
- 3.3 Waterstof
- 3.4 Stikstof
- 3.5 Fosfor
- 3.6 Zwavel
- 3.7 Calcium
- 3.8 Magnesium
- 3.9 Natrium en kalium
- 3.10 IJzer
- 3.11 Fluor
- 3.12 Lithium
- 4 referenties
Kenmerken
Biogenetische elementen hebben een reeks chemische eigenschappen die ze geschikt maken om deel uit te maken van levende systemen:
Covalente bindingen
Ze zijn in staat om covalente bindingen te vormen, waarbij de twee atomen worden verbonden door elektronen uit hun valentieschil te delen. Wanneer deze binding wordt gevormd, bevinden de gedeelde elektronen zich in de internucleaire ruimte.
Deze bindingen zijn vrij sterk en stabiel, een aandoening die aanwezig moet zijn in de moleculen van levende organismen. Evenzo zijn deze bindingen niet extreem moeilijk te verbreken, waardoor een zekere mate van moleculaire dynamica tot stand kan worden gebracht..
Mogelijkheid om enkele, dubbele en drievoudige bindingen te vormen
Een aanzienlijk aantal moleculen met weinig elementen kan worden gevormd dankzij het vermogen om enkele, dubbele en drievoudige bindingen te vormen.
Deze eigenschap biedt niet alleen een aanzienlijke moleculaire variatie, maar maakt ook de vorming mogelijk van structuren met verschillende rangschikkingen (onder andere lineair, ringvormig)..
Classificatie
Biogenetische elementen worden ingedeeld in primaire, secundaire en sporenelementen. Deze opstelling is gebaseerd op de verschillende verhoudingen van de elementen in levende wezens.
In de meeste organismen worden deze verhoudingen gehandhaafd, hoewel er bepaalde specifieke variaties kunnen zijn. Bij gewervelde dieren is jodium bijvoorbeeld een cruciaal element, terwijl bij de andere taxa het lijkt niet het geval te zijn.
Primaire elementen
Het droge gewicht van levende materie bestaat voor 95 tot 99% uit deze chemische elementen. In deze groep vinden we de meest voorkomende elementen: waterstof, zuurstof, stikstof en koolstof..
Deze elementen kunnen uitstekend met andere worden gecombineerd. Bovendien hebben ze het kenmerk dat ze meerdere schakels vormen. Koolstof kan tot drievoudige bindingen vormen en een verscheidenheid aan organische moleculen genereren.
Secundaire elementen
De elementen van deze groep vormen 0,7% tot 4,5% van de levende materie. Het zijn natrium, kalium, calcium, magnesium, chloor, zwavel en fosfor.
In organismen worden secundaire elementen aangetroffen in hun ionische vorm; daarom worden ze elektrolyten genoemd. Afhankelijk van hun lading kunnen ze worden geclassificeerd als kationen (+) of anionen (-)
Over het algemeen nemen elektrolyten deel aan osmotische regulatie, aan de zenuwimpuls en aan het transport van biomoleculen.
Osmotische verschijnselen verwijzen naar de juiste balans van water in de cellulaire omgeving en daarbuiten. Evenzo spelen ze een rol bij het handhaven van de pH in cellulaire omgevingen; staan bekend als buffers of bufferoplossingen.
Spoorelementen
Ze worden aangetroffen in kleine of sporenverhoudingen, ongeveer waarden van minder dan 0,5%. Zijn aanwezigheid in kleine hoeveelheden geeft echter niet aan dat zijn rol niet belangrijk is. In feite zijn ze even essentieel als de vorige groepen voor een goede werking van het levende organisme..
Deze groep bestaat uit ijzer, magnesium, kobalt, koper, zink, molybdeen, jodium en fluor. Net als de groep secundaire elementen kunnen sporenelementen in hun ionische vorm zijn en elektrolyten zijn.
Een van de meest relevante eigenschappen is om als een stabiel ion te blijven in zijn verschillende oxidatietoestanden. Ze zijn te vinden in de actieve centra van enzymen (fysieke ruimte van het eiwit waar de reactie plaatsvindt) of werken in op moleculen die elektronen overdragen.
Andere auteurs hebben de neiging om bio-elementen als essentieel en niet-essentieel te classificeren. De classificatie volgens zijn overvloed wordt echter het meest gebruikt.
Kenmerken
Elk van de biognesische elementen vervult een essentiële en specifieke functie in het lichaam. Onder de meest relevante functies kunnen we het volgende noemen:
Koolstof
Koolstof is de belangrijkste "bouwsteen" van organische moleculen.
Zuurstof
Zuurstof speelt een rol bij ademhalingsprocessen en is ook een primaire component in de verschillende organische moleculen.
Waterstof
Het wordt gevonden in water en maakt deel uit van organische moleculen. Het is erg veelzijdig, omdat het aan elk ander element kan worden gekoppeld.
Stikstof
Komt voor in eiwitten, nucleïnezuren en bepaalde vitamines.
Bij elkaar passen
Fosfor wordt aangetroffen in ATP (adenosinetrifosfaat), een energiemolecuul dat veel wordt gebruikt bij het metabolisme. Het is de energie-valuta van de cellen.
Evenzo maakt fosfor deel uit van het genetisch materiaal (DNA) en in bepaalde vitamines. Het wordt aangetroffen in fosfolipiden, cruciale elementen voor de vorming van biologische membranen.
Zwavel
Zwavel wordt aangetroffen in sommige aminozuren, met name cysteïne en methionine. Het is aanwezig in co-enzym A, een tussenmolecuul dat een groot aantal metabole reacties mogelijk maakt.
Calcium
Calcium is essentieel voor botten. Spiercontractieprocessen vereisen dit element. Spiercontractie en bloedstolling worden ook gemedieerd door dit ion.
Magnesium
Magnesium is vooral belangrijk in planten, omdat het wordt aangetroffen in het chlorofylmolecuul. Als ion neemt het als cofactor deel aan verschillende enzymatische routes.
Natrium en kalium
Het zijn overvloedige ionen in respectievelijk het extracellulaire en intracellulaire medium. Deze elektrolyten zijn de hoofdrolspelers van de zenuwimpuls, aangezien ze de membraanpotentiaal bepalen. Deze ionen staan bekend om de natrium-kaliumpomp.
Ijzer
Het zit in hemoglobine, een eiwit dat aanwezig is in bloederytrocyten en waarvan de functie het transport van zuurstof is.
Fluor
Fluoride is aanwezig in tanden en botten.
Lithium
Lithium heeft neurologische functies.
Referenties
- Cerezo García, M. (2013). Fundamentals of Basic Biology. Publicaties van de Universitat Jaume I.
- Galan, R., en Torronteras, S. (2015). Fundamentele en gezondheidsbiologie. Elsevier
- Gama, M. (2007). Biologie: een constructivistische benadering. Pearson Education.
- Macarulla, J. M., & Goñi, F. M. (1994). Menselijke biochemie: basiscursus. Omgekeerd.
- Teijón, J. M. (2006). Structurele biochemische grondbeginselen. Redactioneel Tébar.
- Urdiales, B. A. V., del Pilar Granillo, M., & Dominguez, M. D. S. V. (2000). Algemene biologie: levende systemen. Grupo Redactie Patria.
- Vallespí, R. M. C., Ramírez, P. C., Santos, S. E., Morales, A. F., Torralba, M. P., & Del Castillo, D.S. (2013). Belangrijkste chemische verbindingen. Redactioneel UNED.



Niemand heeft nog op dit artikel gereageerd.