
Karakteristieken en voorbeelden van polaire covalente bindingen

EEN polaire covalente binding Het is gevormd tussen twee chemische elementen waarvan het elektronegativiteitsverschil aanzienlijk is, maar zonder een puur ionisch karakter te benaderen. Het is daarom een sterke tussenliggende interactie tussen de apolaire covalente bindingen en de ionische bindingen..
Er wordt gezegd dat het covalent is omdat er in theorie een gelijke verdeling is van een elektronisch paar tussen de twee gebonden atomen; dat wil zeggen, de twee elektronen worden gelijk verdeeld. Het atoom E schenkt een elektron, terwijl X het tweede elektron bijdraagt om de covalente binding E: X of E-X te vormen.
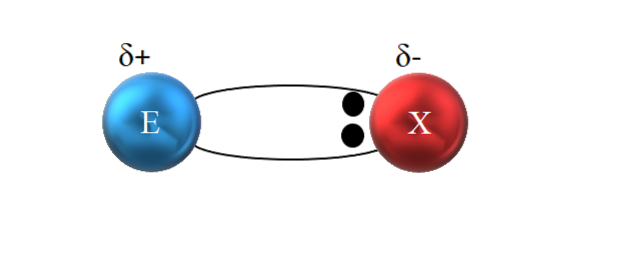
Zoals te zien is in de afbeelding hierboven, bevinden de twee elektronen zich echter niet in het midden van E en X, wat aangeeft dat ze met dezelfde frequentie tussen beide atomen "circuleren"; ze zijn eerder dichter bij X dan bij E. Dit betekent dat X het elektronenpaar naar zich toe heeft getrokken vanwege de hogere elektronegativiteit.
Omdat de elektronen van de binding dichter bij X dan bij E zijn, wordt rond X een gebied met een hoge elektronendichtheid gecreëerd, δ-; terwijl in E een elektronenarm gebied verschijnt, δ +. Daarom is er een polarisatie van elektrische ladingen: een polaire covalente binding.
Artikel index
- 1 Kenmerken
- 1.1 Graden van polariteit
- 1.2 Chemische elementen waaruit ze afkomstig zijn
- 1.3 Polair en ionisch karakter
- 2 Voorbeelden van polaire covalente binding
- 2.1 C-O
- 2.2 H-X
- 2.3 O-H
- 2,4 N-H
- 2,5 Fe-O
- 3 referenties
Kenmerken
Graden van polariteit
Covalente bindingen zijn zeer overvloedig van aard. Ze zijn aanwezig in praktisch alle heterogene moleculen en chemische verbindingen; omdat het uiteindelijk wordt gevormd wanneer twee verschillende atomen E en X binden. Er zijn echter covalente bindingen meer polair dan andere, en om erachter te komen, moet men zijn toevlucht nemen tot elektronegativiteiten.
Hoe meer elektronegatief X is, en hoe minder elektronegatief E is (elektropositief), dan zal de resulterende covalente binding meer polair zijn. De conventionele manier om deze polariteit te schatten is door middel van de formule:
χX - χEN
Waar χ de elektronegativiteit is van elk atoom volgens de Pauling-schaal.
Als dit aftrekken of aftrekken waarden heeft tussen 0,5 en 2, dan is het een polaire binding. Daarom is het mogelijk om de mate van polariteit tussen verschillende E-X-verbindingen te vergelijken. Als de verkregen waarde hoger is dan 2, spreken we van een ionische binding, E+X- En dat is het nietδ+-Xδ-.
De polariteit van de E-X-binding is echter niet absoluut, maar hangt af van de moleculaire omgeving; dat wil zeggen, in een molecuul -E-X-, waar E en X covalente bindingen vormen met andere atomen, beïnvloeden deze laatste direct genoemde mate van polariteit.
Chemische elementen waaruit ze afkomstig zijn
Hoewel E en X elk element kunnen zijn, veroorzaken ze niet allemaal polaire covalente bindingen. Als E bijvoorbeeld een sterk elektropositief metaal is, zoals de alkalische (Li, Na, K, Rb en Cs), en X een halogeen is (F, Cl, Br en I), zullen ze de neiging hebben om ionische verbindingen te vormen. (Na+Cl-) en geen moleculen (Na-Cl).
Dat is de reden waarom polaire covalente bindingen meestal worden gevonden tussen twee niet-metalen elementen; en in mindere mate tussen niet-metalen elementen en sommige overgangsmetalen. Kijken naar het blok p van het periodiek systeem, heb je veel opties om dit soort chemische bindingen te vormen.
Polair en ionisch karakter
Bij grote moleculen is het niet erg belangrijk om na te denken over hoe polair een binding is; Deze zijn zeer covalent en de verdeling van hun elektrische ladingen (waar de elektronenrijke of arme gebieden zijn) trekt meer aandacht dan het bepalen van de mate van covalentie van hun interne bindingen..
Bij diatomische of kleine moleculen is de polariteit Eδ+-Xδ- het is nogal relatief.
Dit is geen probleem met moleculen gevormd tussen niet-metalen elementen; Maar wanneer overgangsmetalen of metalloïden deelnemen, spreken we niet langer alleen van een polaire covalente binding, maar van een covalente binding met een bepaald ionisch karakter; en in het geval van overgangsmetalen, van een covalente coördinatiebinding gezien zijn aard.
Voorbeelden van polaire covalente binding
CO
De covalente binding tussen koolstof en zuurstof is polair, omdat de eerste minder elektronegatief is (χC = 2,55) dan de tweede (χOF = 3,44). Daarom, als we de C-O-, C = O- of C-O-bindingen zien-, we zullen weten dat het polaire banden zijn.
H-X
Waterstofhalogeniden, HX, zijn ideale voorbeelden om de polaire binding in uw twee atomen moleculen te begrijpen. Met de elektronegativiteit van waterstof (χH. = 2.2), kunnen we schatten hoe polair deze halogeniden ten opzichte van elkaar zijn:
-HF (H-F), χF. (3,98) - χH. (2,2) = 1,78
-HCl (H-Cl), χCl (3.16) - χH. (2,2) = 0,96
-HBr (H-Br), χBr (2,96) - χH. (2,2) = 0,76
-HI (H-I), χik (2,66) - χH. (2,2) = 0,46
Merk op dat volgens deze berekeningen de H-F-binding de meest polaire van allemaal is. Welnu, wat is het ionische karakter ervan uitgedrukt als een percentage, is een andere zaak. Dit resultaat is niet verrassend, want fluor is het meest elektronegatieve element van allemaal..
Naarmate de elektronegativiteit van chloor naar jodium daalt, worden de H-Cl-, H-Br- en H-I-bindingen ook minder polair. De H-I-binding zou apolair moeten zijn, maar is in feite polair en ook erg "broos"; breekt gemakkelijk.
OH
De O-H polaire binding is misschien wel de belangrijkste van allemaal: dankzij haar bestaat er leven, omdat ze samenwerkt met het dipoolmoment van water. Als we het verschil tussen de elektronegativiteiten van zuurstof en waterstof schatten, hebben we:
χOF (3,44) - χH. (2,2) = 1,24
Het watermolecuul, HtweeOf je hebt twee van deze bindingen, H-O-H. Dit, en de hoekige geometrie van het molecuul en zijn asymmetrie, maken het tot een zeer polaire verbinding..
N-H
De N-H-binding is aanwezig in de aminogroepen van eiwitten. We herhalen dezelfde berekening die we hebben:
χN (3.04) - χH. (2,2) = 0,84
Dit geeft aan dat de NH-binding minder polair is dan O-H (1,24) en F-H (1,78).
Lelijk
De Fe-O-binding is belangrijk omdat de oxiden ervan worden aangetroffen in ijzermineralen. Laten we eens kijken of het meer polair is dan H-O:
χOF (3,44) - χGeloof (1,83) = 1,61
Daarom wordt terecht aangenomen dat de Fe-O-binding meer polair is dan de H-O (1,24) -binding; of wat is hetzelfde als zeggen: Fe-O heeft een groter ionisch karakter dan H-O.
Deze berekeningen worden gebruikt om de polariteitsgraden tussen verschillende schakels te bepalen; maar ze zijn niet voldoende om te bepalen of een verbinding ionisch, covalent of het ionische karakter ervan is.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Laura Nappi. (2019). Polaire en niet-polaire covalente bindingen: definities en voorbeelden. Studie. Hersteld van: study.com
- Helmenstine, Anne Marie, Ph.D. (18 september 2019). Polar Bond-definitie en voorbeelden (Polar Covalent Bond). Hersteld van: thoughtco.com
- Elsevier B.V. (2019). Polar covalente binding. ScienceDirect. Hersteld van: sciencedirect.com
- Wikipedia. (2019). Chemische polariteit. Hersteld van: en.wikipedia.org
- Anoniem. (05 juni 2019). Eigenschappen van polaire covalente bindingen. Chemie LibreTexts. Hersteld van: chem.libretexts.org


Niemand heeft nog op dit artikel gereageerd.