
Link Pi hoe het is gevormd, kenmerken en voorbeelden
EEN pi link (π) is een soort covalente binding die wordt gekenmerkt door het verhinderen van de vrije rotatiebeweging van atomen en door ontstaan tussen een paar pure-type atomaire orbitalen, naast andere eigenaardigheden. Er zijn bindingen die kunnen worden gevormd tussen atomen door hun elektronen, waardoor ze grotere en complexere structuren kunnen bouwen: moleculen.
Deze obligaties kunnen van verschillende variëteiten zijn, maar de meest voorkomende in dit vakgebied zijn de covalenten. Covalente bindingen, ook wel moleculaire bindingen genoemd, zijn een soort binding waarbij de betrokken atomen paren elektronen delen.
Dit kan gebeuren door de noodzaak van de atomen om stabiliteit te zoeken, waardoor de meeste bekende verbindingen worden gevormd. In die zin kunnen covalente bindingen enkelvoudig, dubbel of drievoudig zijn, afhankelijk van de configuratie van hun orbitalen en het aantal elektronenparen dat tussen de betrokken atomen wordt gedeeld..
Dit is de reden waarom er twee soorten covalente bindingen zijn die worden gevormd tussen atomen op basis van de oriëntatie van hun orbitalen: sigma (σ) -bindingen en pi (π) -bindingen..
Het is belangrijk om beide bindingen te differentiëren, aangezien de sigma-binding voorkomt in eenvoudige bindingen en pi in meerdere bindingen tussen atomen (twee of meer elektronen worden gedeeld).
Artikel index
- 1 Hoe wordt het gevormd?
- 1.1 Vorming van pi-bindingen in verschillende chemische soorten
- 2 kenmerken
- 3 voorbeelden
- 4 referenties
Hoe wordt het gevormd?
Om de vorming van de pi-binding te beschrijven, moet eerst het hybridisatieproces worden besproken, aangezien het ingrijpt in enkele belangrijke bindingen..
Hybridisatie is een proces waarbij hybride elektronische orbitalen worden gevormd; dat wil zeggen, waar s en p atomaire subniveau-orbitalen kunnen mengen. Dit veroorzaakt de vorming van sp-, sp-orbitalentwee en sp3, die hybriden worden genoemd.
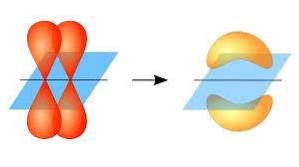
In die zin vindt de vorming van pi-bindingen plaats dankzij de overlapping van een paar lobben die behoren tot een atoombaan op een ander paar lobben die zich in een orbitaal bevinden die deel uitmaakt van een ander atoom..
Deze orbitale overlapping treedt lateraal op, waarbij de elektronische distributie voornamelijk geconcentreerd is boven en onder het vlak gevormd door de gebonden atoomkernen, en zorgt ervoor dat de pi-bindingen zwakker zijn dan de sigma-bindingen..
Wanneer we het hebben over de orbitale symmetrie van dit type unie, moet worden vermeld dat deze gelijk is aan die van de orbitalen van het p-type, zolang het wordt waargenomen door de as die wordt gevormd door de binding. Bovendien bestaan deze vakbonden meestal uit p-orbitalen..
Vorming van pi-bindingen in verschillende chemische soorten
Omdat pi-bindingen altijd gepaard gaan met een of twee extra bindingen (één sigma of een andere pi en één sigma), is het relevant om te weten dat de dubbele binding die wordt gevormd tussen twee koolstofatomen (bestaande uit één sigma en één pi-binding) heeft een lagere bindingsenergie dan die overeenkomt met tweemaal de sigma-binding tussen de twee.
Dit wordt verklaard door de stabiliteit van de sigma-binding, die groter is dan die van de pi-binding, omdat de overlapping van atomaire orbitalen in de laatste parallel plaatsvindt in de gebieden boven en onder de lobben, waardoor de elektronische distributie in een meer verre weg van atoomkernen.
Desondanks wordt, wanneer pi- en sigma-bindingen worden gecombineerd, een sterkere meervoudige binding gevormd dan de enkele binding zelf, wat kan worden geverifieerd door de bindingslengtes tussen verschillende enkele en meervoudige bindingsatomen te observeren..
Er zijn enkele chemische soorten die worden bestudeerd vanwege hun uitzonderlijke gedrag, zoals coördinatieverbindingen met metaalelementen, waarbij de centrale atomen alleen zijn verbonden door pi-bindingen..
Kenmerken
De kenmerken die pi-bindingen onderscheiden van andere soorten interacties tussen atomaire soorten, worden hieronder beschreven, te beginnen met het feit dat deze binding geen vrije rotatiebeweging van atomen, zoals koolstof, toelaat. Om deze reden, als er rotatie van de atomen is, breekt de binding..
Evenzo vindt in deze verbindingen de overlap tussen de orbitalen plaats via twee parallelle gebieden, waardoor wordt bereikt dat ze een grotere diffusie hebben dan de sigma-links en dat ze om deze reden zwakker zijn..
Aan de andere kant, zoals hierboven vermeld, wordt de pi-binding altijd gegenereerd tussen een paar pure atomaire orbitalen; Dit betekent dat het wordt gegenereerd tussen orbitalen die geen hybridisatieprocessen hebben ondergaan, waarbij de dichtheid van de elektronen voornamelijk boven en onder het vlak is geconcentreerd dat wordt gevormd door de covalente binding..
In die zin kan er tussen een paar atomen meer dan één pi-binding zijn, altijd vergezeld van een sigma-binding (in de dubbele bindingen).
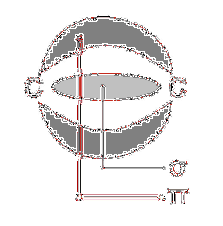
Evenzo kan er een drievoudige binding zijn tussen twee aangrenzende atomen, die wordt gevormd door twee pi-bindingen op posities die vlakken vormen die loodrecht op elkaar staan en een sigma-binding tussen beide atomen..
Voorbeelden
Zoals eerder vermeld, hebben moleculen die bestaan uit atomen die zijn verbonden door een of meer pi-bindingen altijd meerdere bindingen; d.w.z. dubbelspel of drievoudig.
Een voorbeeld hiervan is het ethyleenmolecuul (H.tweeC = CHtwee), die is opgebouwd uit een dubbele binding; dat wil zeggen, een pi en een sigma-binding tussen hun koolstofatomen, naast de sigma-bindingen tussen de koolstofatomen en waterstofatomen.
Het acetyleenmolecuul (H-C≡C-H) van zijn kant heeft een drievoudige binding tussen zijn koolstofatomen; dat wil zeggen, twee pi-bindingen die loodrechte vlakken vormen en één sigma-binding, naast hun overeenkomstige koolstof-waterstof-sigma-bindingen.
Pi-bindingen komen ook voor tussen cyclische moleculen, zoals benzeen (C.6H.6) en zijn derivaten, waarvan de opstelling resulteert in een effect dat resonantie wordt genoemd, waardoor de elektronendichtheid tussen atomen kan migreren en, onder andere, een grotere stabiliteit aan de verbinding kan verlenen..
Om de eerder genoemde uitzonderingen te illustreren, de gevallen van het dicarbon-molecuul (C = C, waarin beide atomen een paar elektronenparen hebben) en de coördinatieverbinding genaamd hexacarbonylijzer (weergegeven als Fetwee(CO)6, die alleen wordt gevormd door pi-bindingen tussen zijn atomen).
Referenties
- Wikipedia. (s.f.). Pi-binding. Opgehaald van en.wikipedia.org
- Chang, R. (2007). Chemistry, negende editie. Mexico: McGraw-Hill.
- ThoughtCo. (s.f.). Pi Bond-definitie in de chemie. Opgehaald van thoughtco.com
- Britannica, E. (s.f.). Pi-binding. Opgehaald van britannica.com
- LibreTexts. (s.f.). Sigma- en Pi-obligaties. Opgehaald van chem.libretexts.org
- Srivastava, A. K. (2008). Organische chemie eenvoudig gemaakt. Opgehaald van books.google.co.ve



Niemand heeft nog op dit artikel gereageerd.