
Structuur, eigenschappen, toepassingen en risico's van ammoniumacetaat
De ammoniumacetaat is een anorganisch zout waarvan de chemische formule NH is4CH3COOH. Het is afgeleid van een mengsel van azijnzuur, aanwezig in commerciële azijn in een concentratie van 5%, en ammoniak. Beide uitgangsstoffen hebben karakteristieke geuren, dus het is mogelijk om een idee te krijgen waarom dit zout naar azijn-ammoniak ruikt.
Het meest opvallende aspect van dit zout is echter niet de geur, maar het lage smeltpunt. Het is zo laag dat het in elk laboratorium kan worden verkregen in de vloeibare versie, waar ionen vrij stromen om elektrische ladingen te transporteren..

Aan de andere kant is ammoniumacetaat vervloeiend; dat wil zeggen, het absorbeert water of vochtigheid uit de omgeving totdat het volledig oplost. Dat is de reden waarom, hoewel de kristallen in watervrije toestand wit zijn, ze snel helder worden (zoals die in de beker in de bovenstaande afbeelding).
Omdat het een vaste bron van ammoniak is, moet het zo worden gehanteerd dat de inademing van de dampen tot een minimum wordt beperkt. Maar ondanks dit negatieve kenmerk, de NH4CH3COOH is nuttig voor de bereiding van bufferoplossingen die voedsel conserveren, en is ook een bestanddeel van bepaalde eiwitextraherende oplosmiddelen.
Artikel index
- 1 Structuur van ammoniumacetaat
- 1.1 Andere samenstellingen en water
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molaire massa
- 2.3 Dichtheid
- 2.4 Smeltpunt
- 2.5 Oplosbaarheid
- 2.6 Stabiliteit
- 2,7 pKa
- 2.8 Standaard formatie-enthalpie
- 3 toepassingen
- 3.1 Analytisch
- 3.2 Middelgrote geleider
- 3.3 Buffer
- 3.4 Op ijs en bodem
- 3.5 Neerslagmiddel
- 3.6 Geneeskunde
- 4 Risico's
- 5 referenties
Structuur van ammoniumacetaat
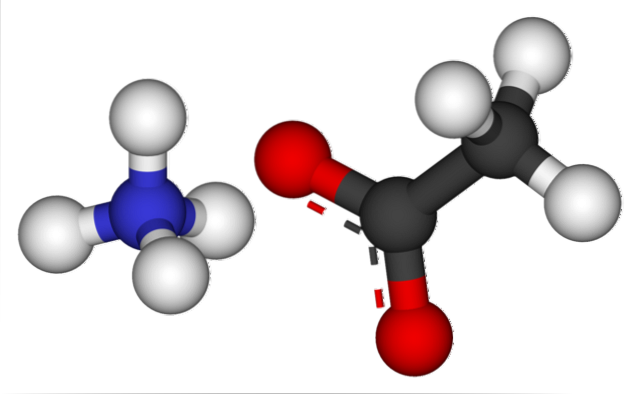
De afbeelding hierboven toont de ionen waaruit ammoniumacetaat bestaat in een bolletjes- en staafmodel. Aan de linkerkant is het kation van de tetraëdrische geometrie, NH4+, terwijl aan de rechterkant het moleculaire anion met twee elektronen is gedelokaliseerd tussen twee zuurstofatomen, CH3COO- (de stippellijn tussen de rode bollen).
Dus beide ionen, NH4+ en CH3COO-, ze worden bij elkaar gehouden door hun elektrostatische aantrekkingskracht die, samen met de afstotingen tussen gelijke ladingen, uiteindelijk een kristal vormt. Dit ammoniumacetaatkristal heeft een orthorhombische structuur, die kan worden waargenomen in microscopisch kleine monsters of zelfs van zichtbare afmetingen..
Niet alleen is ionische binding belangrijk voor dit zout, maar ook waterstofbruggen. NH4+ u kunt maximaal vier van deze bruggen doneren; dat wil zeggen, in elk van de hoekpunten van zijn tetraëder bevindt zich een zuurstofatoom van een CH3COO- buurman (H3N+-H-OCOCH3.
In theorie zouden de krachten in je kristallen dan erg sterk moeten zijn; maar experimenteel gebeurt het tegenovergestelde, aangezien het pas smelt bij 114 ° C. Daarom compenseren waterstofbruggen niet de zwakke ionische binding, noch de lage rooster-energie van het NH orthorhombische kristal.4CH3COO.
Andere composities en water
Oorspronkelijk werd gezegd dat ammoniumacetaat wordt bereid door azijnzuur en ammoniak te mengen. Daarom kan zout ook worden uitgedrukt als: NH3CH3COOH. Zo kunnen, afhankelijk van de samenstelling, andere structuren worden verkregen: NH32CH3COOH of NH35CH3COOH bijvoorbeeld.
Er werd ook vermeld dat het behoorlijk wat vocht opneemt. Daarbij neemt het watermoleculen op in zijn kristallen, die hydrolyseren om NH te geven3 of CH3COOH; en daarom geeft het zout de geur van ammoniak of azijn af.
Eigendommen
Fysiek uiterlijk
Verrukkelijke witte kristallen met een geur van azijn en ammoniak.
Molaire massa
77,083 g / mol.
Dichtheid
1,073 g / ml bij 25 ° C.
Smeltpunt
114 ° C. Deze waarde is aanzienlijk lager in vergelijking met andere zouten of ionische verbindingen. Bovendien mist het een kookpunt door de vorming van ammoniak, wat de afbraak van zout impliceert..
Oplosbaarheid
143 g / 100 ml bij 20 ° C. Let op de buitengewone oplosbaarheid in water, waaruit blijkt dat watermoleculen een affiniteit hebben voor NH-ionen.4+ en CH3COO-, hydrateren ze in waterige sferen.
Zijn oplosbaarheid is niet zo in minder polaire oplosmiddelen. In 100 ml methanol van 15 ° C wordt bijvoorbeeld 7,89 g NH opgelost4CH3COO.
Stabiliteit
Het is vervloeiend, dus bewaar het niet in vochtige ruimtes. Bij het absorberen van water komt ook ammoniak vrij, en daarom ontleedt het.
pKa
9,9.
Deze constante komt overeen met de zuurgraad van het ammoniumion:
NH4+ + B <=> NH3 + HB
Waar HB een zwak zuur is. Als de basis B over water gaat, zal het zijn hydrolysereactie hebben:
NH4+ + H.tweeOF <=> NH3 + H.3OF+
Waarbij de soort H3OF+ definieert de pH van de oplossing.
Aan de andere kant draagt acetaat ook bij aan de pH:
CH3COO- + H.tweeOF <=> CH3COOH + OH-
Dus beide soorten H3OF+ en OH- ze worden geneutraliseerd en geven een neutrale pH van 7. Volgens Pubchem hebben hooggeconcentreerde ammoniumacetaatoplossingen echter een zure pH; wat betekent dat NH-hydrolyse de boventoon voert4+ op de CH3COO-.
Standaard formatie-enthalpie
ΔF.H.298 = -615 kJ / mol.
Toepassingen
Analytisch
Waterige oplossingen van natriumacetaat maken het mogelijk lood-, ijzer- en zinksulfaten oplosbaar te maken, om later hun concentratie te bepalen door middel van atoomabsorptiespectroscopie.
Middelgrote geleider
Omdat het smelt bij een lage temperatuur in vergelijking met andere zouten, kan de vloeistof worden gebruikt om de elektrische stroom te geleiden die het circuit van een gloeilamp verlicht..
Buffer
Het kan pH-veranderingen in zure of basische bereiken reguleren, die wordt gebruikt om een constante pH te behouden in bijvoorbeeld vlees, chocolaatjes, kazen, groenten of andere voedingsproducten.
Op ijs en bodems
Het is een relatief goedkoop en biologisch afbreekbaar zout dat wordt gebruikt om ijzige wegen te ontdooien. Evenzo, omdat het een bron is van in water oplosbare stikstof, wordt het voor landbouwdoeleinden gebruikt om de kaliumspiegel te bepalen..
Neerslagmiddel
Dit zout wordt gebruikt om eiwitten neer te slaan voor chromatografische analyse..
Geneesmiddel
Ammoniumacetaat werkt als een diureticum in de diergeneeskunde en is ook een noodzakelijk zout voor de synthese van insuline en penicilline.
Risico's
Hieronder en tot slot worden enkele risico's of negatieve gevolgen van ammoniumacetaat opgesomd:
- Kan lichte huidirritatie veroorzaken, maar wordt er niet door opgenomen.
- Bij inname veroorzaakt het maagklachten, diarree, diurese, angst, verhoogde behoefte om te plassen, tremoren en andere symptomen die verband houden met ammoniakvergiftiging, evenals schade aan de lever.
- Inademing irriteert de neus, keel en longen.
Voor het overige is niet bekend of het kanker kan veroorzaken en is elk mogelijk brandgevaar door dit zout uitgesloten (in ieder geval onder normale bewaarcondities)..
Referenties
- Inger Nahringbauer. (1967). Waterstofbindingsonderzoeken. XIV. De kristalstructuur van ammoniumacetaat. Instituut voor Chemie, Universiteit van Uppsala, Uppsala, Zweden. Acta Cryst. 23, 956.
- Nationaal centrum voor informatie over biotechnologie. (2019). Ammoniumacetaat. PubChem-database. CID = 517165. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Sullivan Randy. (2012). Geleidbaarheid van ammoniumacetaat. Hersteld van: chemdemos.uoregon.edu
- Viachem, Ltd. (s.f.). Ammoniumacetaat. Hersteld van: viacheminc.com
- Wikipedia. (2019). Ammoniumacetaat. Hersteld van: en.wikipedia.org
- Ministerie van Volksgezondheid van New Jersey. (2012). Ammoniumacetaat - Informatieblad over gevaarlijke stoffen. [Pdf]. Hersteld van: nj.gov
- Xueyanghu. (s.f.). Gebruik en risico's van ammoniumacetaat. Hersteld van: xueyanghu.wordpress.com


Niemand heeft nog op dit artikel gereageerd.