
Quartaire structuur van karakteristieke eiwitten
De quartaire structuur van eiwitten definieert de ruimtelijke relaties tussen elk van zijn polypeptidesubeenheden verbonden door niet-covalente krachten. In polymere eiwitten worden elk van de polypeptideketens waaruit het bestaat, subeenheden of protomeren genoemd.
Eiwitten kunnen bestaan uit één (monomeer), twee (dimeer), meerdere (oligomeer) of veel protomeren (polymeer). Deze protomeren kunnen een vergelijkbare of zeer verschillende moleculaire structuur hebben. In het eerste geval zouden ze homotypische eiwitten zijn en in het tweede geval heterotypisch.
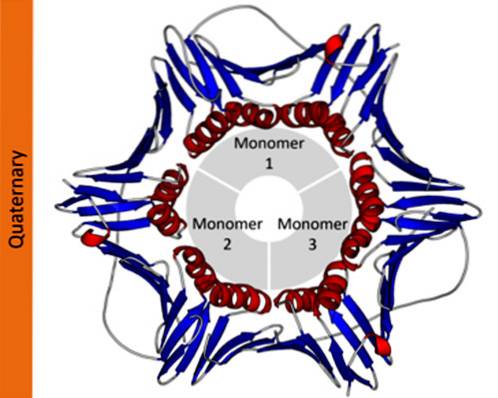
In wetenschappelijke notatie gebruiken biochemici Griekse subscripts om de protomeersamenstelling van eiwitten te beschrijven. Een tetrameer homotypisch eiwit wordt bijvoorbeeld aangeduid als α4, terwijl een tetrameer eiwit dat uit twee verschillende dimeren bestaat, wordt aangeduid als αtweeβtwee.
Artikel index
- 1 Eiwitstructuur
- 1.1 Primaire structuur
- 1.2 Secundaire structuur
- 1.3 Tertiaire structuur
- 1.4 Quartaire structuur
- 2 Stabiliteit van de quartaire structuur
- 2.1 Hydrofobe interacties
- 2.2 Van der Waals-interacties
- 2.3 Interacties tussen belasting en belasting
- 2.4 Waterstofverbindingen
- 2.5 Interacties van dipolen
- 3 Interacties tussen protomeren
- 3.1 Homotypische interacties
- 3.2 Heterotypische interacties
- 4 referenties
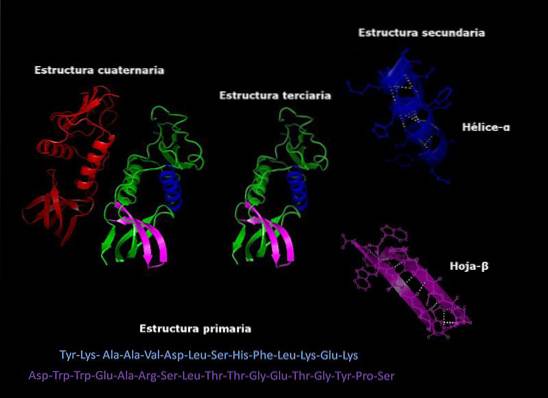
Eiwit structuur
Eiwitten zijn complexe moleculen die verschillende driedimensionale configuraties aannemen. Deze configuraties zijn uniek voor elk eiwit en stellen hen in staat om zeer specifieke functies uit te voeren. De niveaus van structurele organisatie van eiwitten zijn als volgt.
Primaire structuur
Het verwijst naar de volgorde waarin de verschillende aminozuren in de polypeptideketen zijn gerangschikt. Deze sequentie wordt gegeven door de DNA-sequentie die voor het eiwit codeert.
Secundaire structuur
De meeste eiwitten zijn geen volledig verlengde lange ketens van aminozuren, maar hebben eerder gebieden die regelmatig worden gevouwen tot helixen of vellen. Dit vouwen is degene die de naam van secundaire structuur krijgt.
Tertiaire structuur
De gevouwen gebieden van de secundaire structuur kunnen op hun beurt worden gevouwen en samengevoegd tot compactere structuren. Deze laatste vouw geeft het eiwit zijn driedimensionale vorm..
Quartaire structuur
In eiwitten die uit meer dan één subeenheid bestaan, zijn de quaternaire structuren de ruimtelijke relaties die bestaan tussen elke subeenheid, die zijn verbonden door niet-covalente bindingen..
Quartaire structuurstabiliteit
De driedimensionale structuur van eiwitten wordt gestabiliseerd door zwakke of niet-covalente interacties. Hoewel deze bindingen of interacties veel zwakker zijn dan normale covalente bindingen, zijn ze talrijk en is hun cumulatieve effect krachtig. Hier zullen we enkele van de meest voorkomende interacties zien.
Hydrofobe interacties
Sommige aminozuren bevatten hydrofobe zijketens. Wanneer eiwitten deze aminozuren hebben, ordent de vouwing van het molecuul deze zijketens naar het binnenste van het eiwit en beschermt ze tegen water. De aard van de verschillende zijketens betekent dat ze op verschillende manieren bijdragen aan het hydrofobe effect..
Van der Waals-interacties
Deze interacties treden op wanneer moleculen of atomen die niet gebonden zijn door covalente bindingen te dicht bij elkaar komen te staan, en daardoor beginnen hun buitenste elektronische orbitalen te overlappen..
Op dat moment ontstaat er een afstotende kracht tussen deze atomen die zeer snel groeit naarmate hun respectievelijke centra dichterbij komen. Dit zijn de zogenaamde "van der Waals-krachten".
Interacties tussen belasting en belasting
Het is de elektrostatische interactie die optreedt tussen een paar geladen deeltjes. In eiwitten vindt dit soort interactie plaats, zowel door de netto elektrische lading van het eiwit als door de individuele lading van de ionen die het bevat. Dit type interactie wordt ook wel een zoutbrug genoemd..
Waterstofbruggen
Er wordt een waterstofbinding tot stand gebracht tussen een waterstofatoom dat covalent is gebonden aan een donorgroep van een waterstofbinding en een paar vrije elektronen die tot een bindingsacceptorgroep behoren..
Dit type binding is erg belangrijk, omdat de eigenschappen van veel moleculen, inclusief die van water en biologische moleculen, grotendeels te danken zijn aan waterstofbruggen. Het deelt eigenschappen van covalente bindingen (elektronen worden gedeeld) en ook van niet-covalente interacties (lading-ladingsinteractie).
Dipool-interacties
In moleculen, inclusief eiwitten, die geen netto lading vertonen, kan een niet-uniforme rangschikking van hun interne ladingen optreden, waarbij het ene uiterste iets negatiever is dan het andere. Dit is wat bekend staat als een dipool.
Deze dipolaire toestand van het molecuul kan permanent zijn, maar kan ook worden veroorzaakt. Dipolen kunnen worden aangetrokken door ionen of andere dipolen. Als de dipolen permanent zijn, heeft de interactie een grotere reikwijdte dan die welke optreedt bij geïnduceerde dipolen.
Naast deze niet-covalente interacties, stabiliseren sommige oligomere eiwitten hun quaternaire structuur door een soort covalente binding, de disulfidebinding. Deze worden tot stand gebracht tussen de sulfhydrylgroepen van de cysteïnen van verschillende protomeren.
Disulfidebindingen helpen ook bij het stabiliseren van de secundaire structuur van eiwitten, maar in dit geval koppelen ze cysteïnylresten binnen hetzelfde polypeptide (intrapolypeptidedisulfidebindingen)..
Interacties tussen protomeren
Zoals hierboven opgemerkt, kunnen deze subeenheden in eiwitten die uit verschillende subeenheden of protomeren bestaan, vergelijkbaar (homotypisch) of verschillend (heterotypisch) zijn..
Homotypische interacties
De subeenheden waaruit een eiwit bestaat, zijn asymmetrische polypeptideketens. Bij homotypische interacties kunnen deze subeenheden echter op verschillende manieren associëren, waardoor verschillende soorten symmetrie worden bereikt..
De interacterende groepen van elk protomeer bevinden zich over het algemeen op verschillende posities, daarom worden ze heterologe interacties genoemd. Heterologe interacties tussen de verschillende subeenheden, komen soms op een zodanige manier voor dat elke subeenheid verdraaid is ten opzichte van de vorige, waardoor een spiraalvormige structuur kan worden bereikt.
Bij andere gelegenheden vinden de interacties zodanig plaats dat gedefinieerde groepen subeenheden rond een of meer symmetrieassen zijn gerangschikt, in de zogenaamde puntgroepsymmetrie. Wanneer er meerdere symmetrieassen zijn, roteert elke subeenheid ten opzichte van zijn buur 360 ° / n (waarbij n het aantal assen vertegenwoordigt).
Onder de soorten symmetrie die op deze manier worden verkregen, zijn bijvoorbeeld spiraalvormig, kubisch en icosahedraal.
Wanneer twee subeenheden via een binaire as samenwerken, roteert elke eenheid 180 ° ten opzichte van de andere, rond die as. Deze symmetrie staat bekend als C-symmetrietwee. Daarin zijn de interactiesites in elke subeenheid identiek; in dit geval spreken we niet van een heterologe interactie, maar van een isologe interactie.
Als daarentegen de associatie tussen de twee componenten van het dimeer heteroloog is, wordt een asymmetrisch dimeer verkregen.
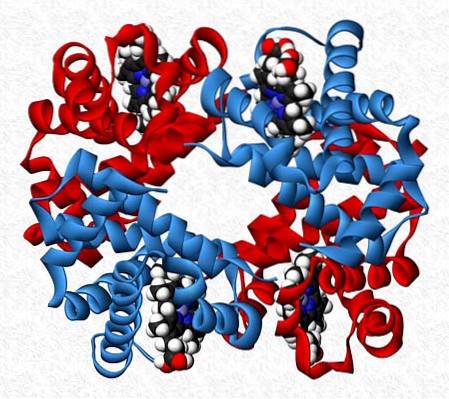
Heterotypische interacties
De interagerende subeenheden in een eiwit zijn niet altijd van dezelfde aard. Er zijn eiwitten die zijn opgebouwd uit twaalf of meer verschillende subeenheden.
De interacties die de stabiliteit van het eiwit behouden, zijn dezelfde als bij homotypische interacties, maar in het algemeen worden volledig asymmetrische moleculen verkregen..
Hemoglobine is bijvoorbeeld een tetrameer met twee paar verschillende subeenheden (αtweeβtwee.
Referenties
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemestry. 3e editie. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper's Biochemestry. Appleton & Lange
- J.M. Berg, J.L. Tymoczko en L. Stryer (2002). Biochemestry. 5e editie. W. H. Freeman and Company.
- J. Koolman & K.-H. Roehm (2005). Kleurenatlas van de biochemie. 2e editie. Thieme.
- A. Lehninger (1978). Biochemie. Ediciones Omega, S.A.
- L. Stryer (1995). Biochemestry. W.H. Freeman and Company, New York.


Niemand heeft nog op dit artikel gereageerd.