
Rutherford experiment geschiedenis, beschrijving en conclusies
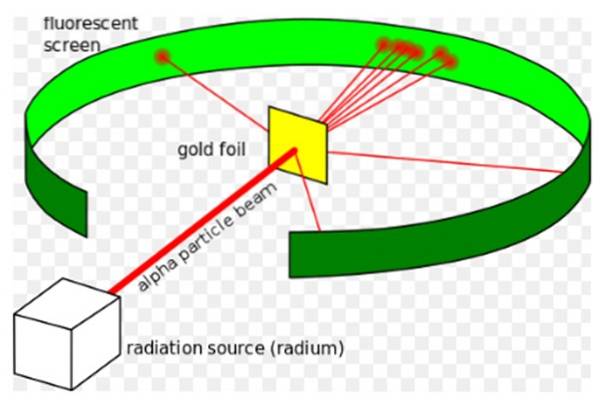
De Rutherford-experiment, uitgevoerd tussen 1908 en 1913, bestond het uit het beschieten van een dunne goudfolie van 0,0004 mm dik met alfadeeltjes en het analyseren van het verspreidingspatroon dat deze deeltjes achterlieten op een fluorescerend scherm.
Rutherford voerde zelfs talloze experimenten uit, waarbij de details steeds verder werden verfijnd. Na een zorgvuldige analyse van de resultaten kwamen twee zeer belangrijke conclusies naar voren:
-De positieve lading van het atoom is geconcentreerd in een gebied genaamd kern.
-Deze atoomkern is ongelooflijk klein in vergelijking met de grootte van het atoom.
Ernest Rutherford (1871-1937) was een in Nieuw-Zeeland geboren natuurkundige die zich bezighield met radioactiviteit en de aard van materie. Radioactiviteit was een recent fenomeen toen Rutherford zijn experimenten begon, het was ontdekt door Henri Becquerel in 1896.
In 1907 ging Rutherford naar de Universiteit van Manchester in Engeland om de structuur van het atoom te bestuderen, waarbij hij deze alfadeeltjes als sondes gebruikte om in zo'n kleine structuur te kijken. Natuurkundigen Hans Geiger en Ernest Marsden vergezelden hem bij de taak..
Ze hoopten te zien hoe een alfadeeltje, dat een dubbel geïoniseerd heliumatoom is, zou interageren met een enkel goudatoom, om ervoor te zorgen dat elke afwijking die het ervoer uitsluitend te wijten was aan elektrische kracht..
De meeste alfadeeltjes passeerden echter met slechts een kleine afwijking door de goudfolie..
Dit feit was in volledige overeenstemming met het atomaire model van Thomson, maar tot verbazing van de onderzoekers vertoonde een klein percentage van de alfadeeltjes een vrij opmerkelijke afwijking..
En een nog kleiner percentage deeltjes zou terugkomen, volledig terugstuiteren. Waar waren deze onverwachte resultaten aan te wijten??
Artikel index
- 1 Beschrijving en conclusies van het experiment
- 1.1 Conclusies
- 2 Invloeden op het model van het atoom
- 2.1 Nadelen van het Rutherford-model
- 2.2 Het proton en het neutron
- 3 Hoe is een schaalmodel van het waterstofatoom?
- 4 Het atomaire model vandaag
- 5 referenties
Beschrijving en conclusies van het experiment
In feite zijn de alfadeeltjes die Rutherford als sonde gebruikte heliumkernen, en op dat moment was alleen bekend dat deze deeltjes positief geladen waren. Tegenwoordig is bekend dat alfadeeltjes bestaan uit twee protonen en twee neutronen..
Alfadeeltjes en bètadeeltjes waren door Rutherford geïdentificeerd als twee verschillende soorten straling van uranium. Alfadeeltjes, veel massiever dan het elektron, hebben een positieve elektrische lading, terwijl bètadeeltjes elektronen of positronen kunnen zijn..
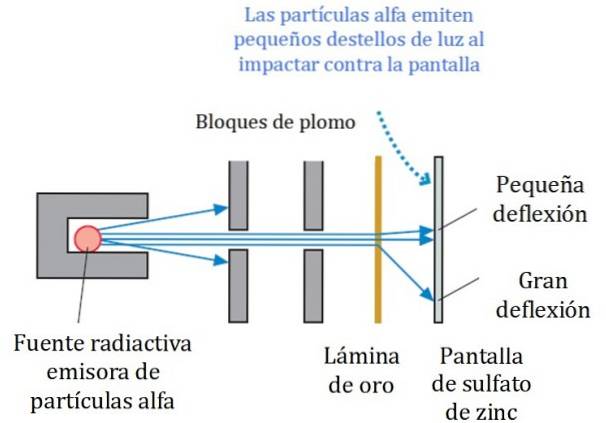
Een vereenvoudigd schema van het experiment wordt getoond in figuur 2. De alfadeeltjesbundel is afkomstig van een radioactieve bron. Geiger en Marsden gebruikten radongas als emitter.
De loden blokken werden gebruikt om de straling naar de goudfolie te richten en te voorkomen dat deze rechtstreeks naar het fluorescerende scherm gaat. Lood is een materiaal dat straling absorbeert.
De aldus gerichte straal werd vervolgens op een dunne gouden folie laten vallen en de meeste deeltjes vervolgden hun weg naar het fluorescerende zinksulfaatscherm, waar ze een klein lichtspoor achterlieten. Geiger had de leiding om ze een voor een te tellen, hoewel ze later een apparaat ontwierpen dat het deed.
Het feit dat sommige deeltjes een kleine afbuiging ondergingen, verbaasde Rutherford, Geiger en Marsden niet. Er zijn immers positieve en negatieve ladingen op het atoom die krachten uitoefenen op de alfadeeltjes, maar aangezien het atoom neutraal is, wat ze al wisten, moesten de afwijkingen klein zijn..
De verrassing van het experiment is dat een paar positieve deeltjes vrijwel direct teruggekaatst werden..
Conclusies
Ongeveer 1 op de 8000 alfadeeltjes werd afgebogen onder hoeken groter dan 90º. Weinig, maar genoeg om een aantal dingen in twijfel te trekken.
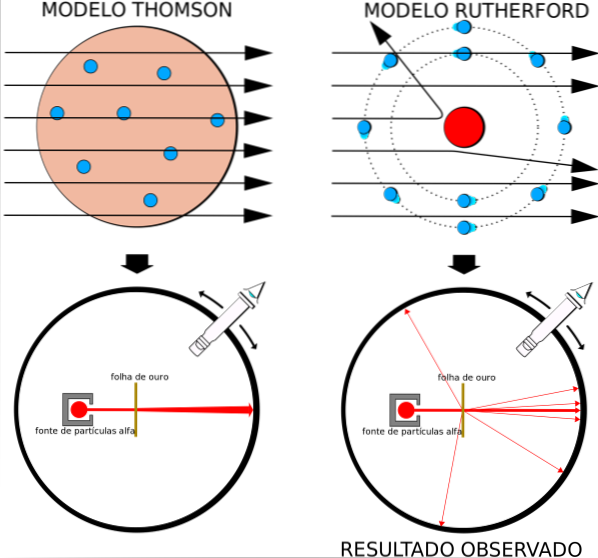
Het atoommodel dat in zwang was, was dat van rozijnenpudding door Thomson, Rutherfords voormalige professor aan het Cavendish Laboratory, maar Rutherford vroeg zich af of het idee van een atoom zonder kern en met elektronen ingebed als rozijnen, juist was..
Want het blijkt dat deze grote afbuigingen van alfadeeltjes, en het feit dat er enkele kunnen terugkeren, alleen verklaard kunnen worden als een atoom een kleine, zware, positieve kern heeft. Rutherford nam aan dat alleen de elektrische aantrekkingskracht en afstotende krachten, zoals aangegeven door de wet van Coulomb, verantwoordelijk waren voor elke afwijking..
Wanneer sommige van de alfadeeltjes rechtstreeks naar deze kern naderen en aangezien de elektrische kracht varieert met het inverse kwadraat van de afstand, voelen ze een afstoting die hen de groothoekverstrooiing of de achterwaartse afbuiging veroorzaakt..
Zeker, Geiger en Marsden experimenteerden door platen van verschillende metalen te beschieten, niet alleen goud, hoewel dit metaal het meest geschikt was vanwege zijn kneedbaarheid, om zeer dunne platen te maken..
Door soortgelijke resultaten te verkrijgen, was Rutherford ervan overtuigd dat de positieve lading in het atoom zich in de kern moest bevinden en niet verspreid over het volume, zoals Thomson in zijn model stelde..
Aan de andere kant, aangezien de overgrote meerderheid van de alfadeeltjes zonder afwijking passeerde, moest de kern heel, heel klein zijn in vergelijking met de atomaire grootte. Deze kern moest echter het grootste deel van de massa van het atoom concentreren.
Invloeden op het model van het atoom
De resultaten verrasten Rutherford enorm, die op een conferentie in Cambridge verklaarde: '... Het is alsof je een 15-inch kanonskogel op een vel vloeipapier afvuurt en het projectiel recht op je af stuitert en je raakt..
Omdat deze resultaten niet konden worden verklaard door het atomaire model van Thomson, stelde Rutherford voor dat het atoom bestaat uit een kern, heel klein, heel massief en positief geladen. De elektronen bleven in banen om hem heen, als een miniatuurzonnestelsel.
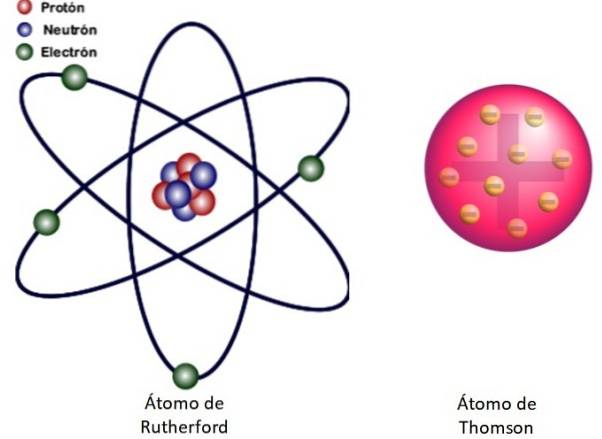
Dit is waar het nucleaire model van het atoom getoond in figuur 3 aan de linkerkant over gaat. Omdat de elektronen ook heel, heel klein zijn, blijkt dat het atoom bijna alles is…. leeg! Daarom passeren de meeste alfadeeltjes nauwelijks afgebogen door de plaat..
En de analogie met een miniatuurzonnestelsel is zeer nauwkeurig. De atoomkern speelt de rol van de zon en bevat bijna alle massa plus de positieve lading. Elektronen draaien er als planeten omheen en hebben een negatieve lading. Het geheel is elektrisch neutraal.
Over de verdeling van elektronen in het atoom, toonde Rutherfords experiment niets aan. Je zou kunnen denken dat de alfadeeltjes er enige interactie mee zouden hebben, maar de massa van de elektronen is te klein en ze waren niet in staat de deeltjes significant af te buigen..
Nadelen van het Rutherford-model
Een probleem met dit atomaire model was precies het gedrag van de elektronen.
Als deze niet statisch waren, maar in cirkelvormige of elliptische banen om de atoomkern cirkelden, gestuurd door elektrische aantrekking, zouden ze uiteindelijk naar de kern vallen..
Dit komt omdat de versnelde elektronen energie verliezen, en als dat gebeurt, zou het de ineenstorting van het atoom en de materie zijn..
Gelukkig is dit niet wat er gebeurt. Er is een soort dynamische stabiliteit die instorten voorkomt. Het volgende atomaire model, na dat van Rutherford, was dat van Bohr, dat enkele antwoorden gaf waarom atomaire ineenstorting niet plaatsvindt.
Het proton en het neutron
Rutherford bleef verstrooiingsexperimenten doen. Tussen 1917 en 1918 kozen hij en zijn assistent William Kay ervoor om gasvormige stikstofatomen te bombarderen met de zeer energetische alfadeeltjes van bismut-214..
Hij was opnieuw verrast toen hij waterstofkernen ontdekte. Dit is de vergelijking van de reactie, de eerste kunstmatige nucleaire transmutatie ooit bereikt:
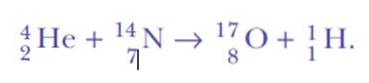
Het antwoord was: uit dezelfde stikstof. Rutherford had waterstof het atoomnummer 1 toegekend, omdat dit het eenvoudigste element is: een positieve kern en een negatief elektron.
Rutherford had een fundamenteel deeltje gevonden dat hij noemde proton, een naam afgeleid van het Griekse woord voor Eerste. Op deze manier is het proton een essentieel bestanddeel van elke atoomkern..
Later, rond 1920, stelde Rutherford voor dat er een neutraal deeltje moet zijn met een massa die sterk lijkt op die van het proton. Hij noemde dit deeltje neutron en het maakt deel uit van bijna alle bekende atomen. Fysicus James Chadwick ontdekte het uiteindelijk in 1932.
Hoe is een schaalmodel van het waterstofatoom?
Het waterstofatoom is, zoals we al zeiden, het eenvoudigste van allemaal. Het was echter niet eenvoudig om voor dit atoom een model te ontwikkelen..
Opeenvolgende ontdekkingen leidden tot kwantumfysica en een hele theorie die verschijnselen op atomaire schaal beschrijft. Tijdens dit proces evolueerde ook het atomaire model. Maar laten we eens kijken naar de kwestie van de maten:
Het waterstofatoom heeft een kern die bestaat uit één proton (positief) en een enkel elektron (negatief).
De straal van het waterstofatoom wordt geschat op 2,1 x 10-10 m, terwijl dat van het proton 0,85 x 10 is -vijftien m of 0,85 femtometers. De naam van deze kleine unit is te danken aan Enrico Fermi en wordt veel gebruikt bij het werken op deze schaal.
Welnu, het quotiënt tussen de straal van het atoom en die van de kern is in de orde van 105 m, dat wil zeggen, het atoom is 100.000 keer groter dan de kern!!.
Er moet echter rekening mee worden gehouden dat in het hedendaagse model, gebaseerd op de kwantummechanica, het elektron de kern omhult in een soort wolk genaamd orbitaal (een orbitaal is geen baan) en het elektron is op atomaire schaal niet punctueel.
Als het waterstofatoom - fantasierijk - zou worden vergroot tot de grootte van een voetbalveld, dan zou de kern die is samengesteld uit een positief proton de grootte hebben van een mier in het midden van het veld, terwijl het negatieve elektron als een soort geest zou zijn. , verspreid over het veld en rondom de positieve kern.
Het atomaire model vandaag
Dit atomaire model van het "planetaire type" is erg ingebakken en is het beeld dat de meeste mensen van het atoom hebben, aangezien het heel gemakkelijk te visualiseren is. Echter, Het is niet het model dat vandaag op wetenschappelijk gebied wordt geaccepteerd.
Hedendaagse atomaire modellen zijn gebaseerd op kwantummechanica. Ze wijst erop dat het elektron in het atoom geen negatief geladen stip is die precieze banen volgt, zoals Rutherford zich had voorgesteld..
Het elektron is dat eerder verspreide in zones, rond de positieve kern, genaamd atomaire orbitalen. Van hem kunnen we het weten waarschijnlijkheid om in een of andere staat te zijn.
Desondanks vertegenwoordigde het model van Rutherford een enorme vooruitgang in het begrip van de inwendige structuur van het atoom. En het maakte de weg vrij voor meer onderzoekers om het verder te verfijnen..
Referenties
- Andriessen, M. 2001. HSC-cursus. Natuurkunde 2. Jacaranda HSC Science.
- Arfken, G. 1984. University Physics. Academische pers.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Fysica OpenLab. Het Rutherford-Geiger-Marsden-experiment. Hersteld van: physicsopenlab.org.
- Rex, A. 2011. Physics Fundamentals. Pearson.
- Tyson, T. 2013. Het Rutherford-verstrooiingsexperiment. Teruggeplaatst van: 122.physics.ucdavis.edu.
- Xaktly. Rutherford's experimenten. Hersteld van: xaktly.com.
- Wikipedia. Rutherfords experiment. Hersteld van: es.wikipedia.org.


Niemand heeft nog op dit artikel gereageerd.