
Calciumfosfaat (Ca3 (PO4) 2) structuur, eigenschappen en toepassingen

De calciumfosfaat is een anorganisch en tertiair zout waarvan de chemische formule Ca is3(PO4twee. De formule stelt dat de samenstelling van dit zout 3: 2 is voor respectievelijk calcium en fosfaat. Dit is direct te zien in de onderstaande afbeelding, waar het kation Ca wordt weergegeven.twee+ en het anion PO43-. Voor elke drie Catwee+ er zijn twee PO43- interactie met hen.
Aan de andere kant verwijst calciumfosfaat naar een reeks zouten die variëren afhankelijk van de Ca / P-verhouding, evenals de mate van hydratatie en pH. In feite zijn er veel soorten calciumfosfaten die bestaan en kunnen worden gesynthetiseerd. Volgens de letterlijke nomenclatuur verwijst calciumfosfaat echter alleen naar het bovengenoemde tricalcium.

Alle calciumfosfaten, inclusief Ca3(PO4twee, ze zijn effen wit met lichtgrijze tinten. Ze kunnen korrelig, fijn, kristallijn zijn en hebben een deeltjesgrootte van ongeveer micron; en er zijn zelfs nanodeeltjes van deze fosfaten gemaakt, waarmee biocompatibele materialen voor botten zijn ontworpen.
Deze biocompatibiliteit is te wijten aan het feit dat deze zouten worden aangetroffen in de tanden en, kort gezegd, in het botweefsel van zoogdieren. Hydroxyapatiet is bijvoorbeeld een kristallijn calciumfosfaat, dat op zijn beurt in wisselwerking staat met een amorfe fase van hetzelfde zout..
Dit betekent dat er amorfe en kristallijne calciumfosfaten zijn. Om die reden is het niet verrassend de diversiteit en de vele opties bij het synthetiseren van materialen op basis van calciumfosfaten; materialen waarvan de eigenschappen elke dag meer onderzoekers wereldwijd geïnteresseerd zijn om zich te concentreren op het herstel van botten.
Artikel index
- 1 Structuur van calciumfosfaat
- 1.1 Amorf calciumfosfaat
- 1.2 De rest van het gezin
- 2 Fysische en chemische eigenschappen
- 2.1 Namen
- 2.2 Molecuulgewicht
- 2.3 Fysieke beschrijving
- 2.4 Smaak
- 2.5 Smeltpunt
- 2.6 Oplosbaarheid
- 2.7 Dichtheid
- 2.8 Brekingsindex
- 2.9 Standaard formatie-enthalpie
- 2.10 Opslagtemperatuur
- 2,11 pH
- 3 Opleiding
- 3.1 Calciumnitraat en ammoniumwaterstoffosfaat
- 3.2 Calciumhydroxide en fosforzuur
- 4 toepassingen
- 4.1 In botweefsel
- 4.2 Biokeramische cementen
- 4.3 Artsen
- 4.4 Andere
- 5 referenties
Structuur van calciumfosfaat
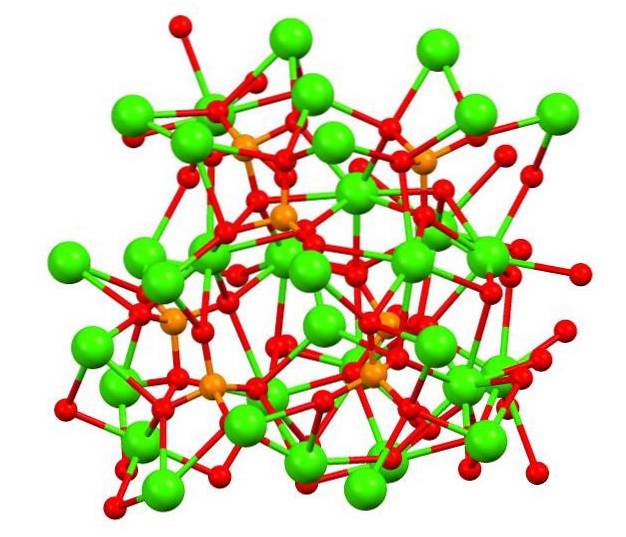
De bovenste afbeelding toont de structuur van tribasisch calicofosfaat in het vreemde mineraal whitlockiet, dat magnesium en ijzer als onzuiverheden kan bevatten..
Hoewel het op het eerste gezicht ingewikkeld lijkt, is het noodzakelijk om duidelijk te maken dat het model uitgaat van covalente interacties tussen de zuurstofatomen van fosfaten en de metaalcentra van calcium..
Bij wijze van weergave is het geldig, maar de interacties zijn elektrostatisch; dat wil zeggen, de kationen Catwee+ worden aangetrokken door PO-anionen43- (ACtwee+- O-PO33-Met dit in gedachten, wordt begrepen waarom in de afbeelding het calcium (groene bollen) wordt omgeven door de negatief geladen zuurstofatomen (rode bollen).
Omdat er zoveel ionen zijn, laat het geen symmetrische opstelling of patroon zichtbaar. De ca.3(PO4twee adopteert bij lage temperaturen (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4twee (β-TCP).
Bij hoge temperaturen verandert het daarentegen in de polymorfe α-Ca3(PO4twee (α-TCP), waarvan de eenheidscel overeenkomt met een monoklien kristalsysteem. Bij nog hogere temperaturen kan ook de polymorf α'-Ca worden gevormd.3(PO4twee, die een hexagonale kristallijne structuur heeft.
Amorf calciumfosfaat
Kristalstructuren zijn genoemd voor calciumfosfaat, wat te verwachten is van een zout. Het is echter in staat ongeordende en asymmetrische structuren te vertonen, die meer verband houden met een soort "calciumfosfaatglas" dan met kristallen in de strikte zin van zijn definitie..
Wanneer dit gebeurt, zou calciumfosfaat een amorfe structuur hebben (ACP, amorf calciumfosfaatVerschillende auteurs wijzen op dit type structuur als verantwoordelijk voor de biologische eigenschappen van Ca3(PO4twee in botweefsels, het herstel en de biomimetisatie ervan is mogelijk.
Door de structuur ervan op te helderen door middel van nucleaire magnetische resonantie (NMR), is de aanwezigheid van OH-ionen gevonden- en HPO4twee- in de ACS. Deze ionen worden gevormd door de hydrolyse van een van de fosfaten:
PO43- + H.tweeOF <=> HPO4twee- + Oh-
Als gevolg hiervan wordt de werkelijke structuur van ACP complexer, waarvan de samenstelling van zijn ionen wordt weergegeven door de formule: Ca9(PO46-x(HPO4X(OH)X. De 'x' geeft de mate van hydratatie aan, want als x = 1, dan zou de formule zijn als: Ca9(PO45(HPO4) (OH).
De verschillende structuren die ACP kan hebben, zijn afhankelijk van de molaire Ca / P-verhoudingen; dat wil zeggen, van de relatieve hoeveelheden calcium en fosfaat, die hun gehele resulterende samenstelling veranderen.
De rest van de familie
Calciumfosfaten zijn in feite een familie van anorganische verbindingen, die op hun beurt kunnen interageren met een organische matrix.
De andere fosfaten worden "eenvoudig" verkregen door de anionen die calcium (PO43-, HPO4twee-, H.tweePO4-, Oh-), evenals het type onzuiverheden in de vaste stof. Zo kunnen tot elf calciumfosfaten of meer, elk met hun eigen structuur en eigenschappen, van nature of kunstmatig ontstaan..
Enkele fosfaten en hun respectievelijke chemische structuren en formules zullen hieronder worden vermeld:
-Calciumwaterstoffosfaat-dihydraat, CaHPO4∙ 2HtweeO: monokliniek.
-Calciumdiwaterstoffosfaat-monohydraat, Ca (H.tweePO4twee∙ HtweeOf: trikliniek.
-Watervrij dizuurfosfaat, Ca (H.tweePO4twee: trikliniek.
-Octacalciumwaterstoffosfaat (OCP), Ca8H.twee(PO46: trikliniek. Het is een voorloper bij de synthese van hydroxyapatiet.
-Hydroxyapatiet, Ca5(PO43OH: zeshoekig.
Fysische en chemische eigenschappen
Namen
-Calciumfosfaat
-Tricalcium fosfaat
-Tricalciumdifosfaat
Molecuulgewicht
310,74 g / mol.
Fysieke beschrijving
Het is een reukloze witte vaste stof.
Smaak
Smaakloos.
Smeltpunt
1670 ºK (1391 ºC).
Oplosbaarheid
-Vrijwel onoplosbaar in water.
-Onoplosbaar in ethanol.
-Oplosbaar in verdund zoutzuur en salpeterzuur.
Dichtheid
3,14 g / cm3.
Brekingsindex
1.629
Standaard formatie-enthalpie
4126 kcal / mol.
Bewaar temperatuur
2-8 ºC.
pH
6-8 in een waterige suspensie van 50 g / l calciumfosfaat.
Opleiding
Calciumnitraat en ammoniumwaterstoffosfaat
Er zijn talloze methoden om calciumfosfaat te produceren of te vormen. Een ervan bestaat uit een mengsel van twee zouten, Ca (NO3twee∙ 4HtweeO, en (NH4tweeHPO4, eerder opgelost in respectievelijk absolute alcohol en water. Het ene zout zorgt voor calcium en het andere voor fosfaat.
Uit dit mengsel slaat het ACP neer, dat vervolgens 2 uur in een oven op 800 ° C wordt verwarmd. Als resultaat van deze procedure wordt de β-Ca verkregen3(PO4twee. Door de temperatuur, het roeren en de contacttijden zorgvuldig te regelen, kunnen nanokristallen ontstaan.
Om de polymorfe α-Ca te vormen3(PO4twee het is noodzakelijk om het fosfaat boven 1000 ° C te verwarmen. Deze verwarming wordt uitgevoerd in aanwezigheid van andere metaalionen, die deze polymorf voldoende stabiliseren zodat deze bij kamertemperatuur kan worden gebruikt; dat wil zeggen, het blijft in een stabiele metatoestand.
Calciumhydroxide en fosforzuur
Calciumfosfaat kan ook worden gevormd door de oplossingen van calciumhydroxide en fosforzuur te mengen, waardoor een zuur-base-neutralisatie ontstaat. Na een halve dag rijping in de moederlogen en de juiste filtratie, wassen, drogen en zeven, wordt een korrelig amorf fosfaatpoeder, ACP, verkregen..
Dit ACP-reactieproduct van hoge temperaturen, transformeert volgens de volgende chemische vergelijkingen:
2Ca9(HPO4) (PO45(OH) => 2Ca9(BlztweeOF70,5(PO45(OH) + HtweeO (bij T = 446,60 ° C)
2Ca9(BlztweeOF70,5(PO45(OH) => 3Ca3(PO4twee + 0,5HtweeO (bij T = 748,56 ° C)
Op deze manier wordt de β-Ca verkregen3(PO4twee, de meest voorkomende en stabiele polymorf.
Toepassingen
In botweefsel
De ca.3(PO4twee het is het belangrijkste anorganische bestanddeel van beenderas. Het is een onderdeel van botvervangende transplantaties, dit wordt verklaard door de chemische gelijkenis met de mineralen die in bot aanwezig zijn.
Calciumfosfaatbiomaterialen worden gebruikt om botdefecten te corrigeren en bij het coaten van titaniummetaalprothesen. Calciumfosfaat zet zich erop af, isoleert ze van de omgeving en vertraagt het titaniumcorrosieproces..
Calciumfosfaten, inclusief Ca3(PO4twee, Ze worden gebruikt om keramische materialen te maken. Deze materialen zijn biocompatibel en worden momenteel gebruikt om alveolair botverlies als gevolg van parodontitis, endodontische infecties en andere aandoeningen te herstellen..
Ze mogen echter alleen worden gebruikt om periapicale botherstel te versnellen, in gebieden waar geen chronische bacteriële infectie is..
Calciumfosfaat kan worden gebruikt om botdefecten te herstellen wanneer een autogeen bottransplantaat niet kan worden gebruikt. Het kan alleen worden gebruikt of in combinatie met een biologisch afbreekbaar en resorbeerbaar polymeer, zoals polyglycolzuur.
Biokeramische cementen
Calciumfosfaatcement (CPC) is een ander biokeramiek dat wordt gebruikt bij het herstel van botweefsel. Het wordt gemaakt door het poeder van verschillende soorten calciumfosfaten met water te mengen, waardoor een pasta ontstaat. De pasta kan worden geïnjecteerd of aangebracht op het botdefect of de holte.
Cementen worden gevormd, geleidelijk geresorbeerd en vervangen door nieuw gevormd bot.
Artsen
-De ca.3(PO4twee Het is een basisch zout, dus het wordt gebruikt als een antacidum om overmatig brandend maagzuur te neutraliseren en de pH te verhogen. In tandpasta's vormt het een bron van calcium en fosfaat om het proces van remineralisatie van de tanden en de hemostase van het bot te vergemakkelijken.
-Het wordt ook gebruikt als voedingssupplement, hoewel de goedkoopste manier om calcium te leveren is door het gebruik van carbonaat en citraat..
-Calciumfosfaat kan worden gebruikt bij de behandeling van tetanie, latente hypocalciëmie en onderhoudstherapie. Bovendien is het nuttig bij calciumsuppletie tijdens zwangerschap en borstvoeding..
-Het wordt gebruikt bij de behandeling van besmetting met radioactieve isotopen radium (Ra-226) en strontium (Sr-90). Calciumfosfaat blokkeert de opname van radioactieve isotopen in het spijsverteringskanaal en beperkt zo de schade die ze veroorzaken.
Anderen
-Calciumfosfaat wordt gebruikt als voer voor vogels. Bovendien wordt het in tandpasta's gebruikt om tandsteen te bestrijden..
-Het wordt gebruikt als antiklontermiddel, bijvoorbeeld om verdichting van keukenzout te voorkomen.
-Het werkt als een bleekmiddel voor meel. Ondertussen voorkomt het bij reuzel ongewenste verkleuring en verbetert het de conditie van het frituren..
Referenties
- Tung M.S. (1998) Calciumfosfaten: structuur, samenstelling, oplosbaarheid en stabiliteit. In: Amjad Z. (eds) Calciumfosfaten in biologische en industriële systemen. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu en Honglian Dai. (2018). "Synthesis, Characterization of Nano-β-Tricalcium Phosphate and the Inhibition on Hepatocellular Carcinoma Cells," Journal of Nanomaterials, vol. 2018, artikel-ID 7083416, 7 pagina's, 2018.
- Combes, Christus en Rey, Christian. (2010). Amorfe calciumfosfaten: synthese, eigenschappen en toepassingen in biomaterialen. Acta Biomaterialia, vol. 6 (n ° 9). pp. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Tricalcium fosfaat. Hersteld van: en.wikipedia.org
- Abida et al. (2017). Tricalciumfosfaatpoeder: Voorbereiding, karakterisering en verdichtingsvermogen. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- PubChem. (2019). Calciumfosfaat. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Calciumfosfaat. Science Direct. Hersteld van: sciencedirect.com



Niemand heeft nog op dit artikel gereageerd.