
Half ontwikkelde formule wat het is en voorbeelden (methaan, propaan, butaan ...)

De half ontwikkelde formule, Ook bekend als de semi-structuurformule, is het een van de vele mogelijke weergaven die aan het molecuul van een verbinding kunnen worden gegeven. Het komt zeer vaak voor in de organische chemie, vooral in academische teksten, omdat het de juiste ordening van een molecuul en zijn covalente bindingen laat zien..
In tegenstelling tot de ontwikkelde formule, die hetzelfde is als de structuurformule, toont deze niet de C-H-bindingen, maar laat deze weg om de weergave te vereenvoudigen. Aan de hand van deze formule kan elke lezer begrijpen wat de ruggengraat van een molecuul is; maar niet de geometrie of een van de stereochemische aspecten.
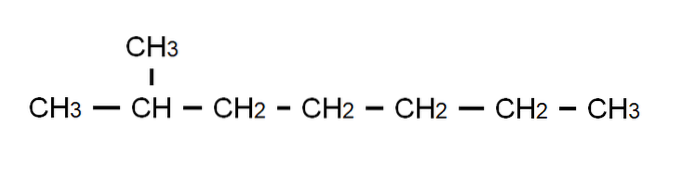
Om dit punt te verduidelijken, hebben we hierboven de halfontwikkelde formule van 2-methylheptaan: een vertakte alkaan waarvan de molecuulformule C is8H.18, en dat voldoet aan de algemene formule CnH.2n + 2. Merk op dat de moleculaire formule helemaal niets zegt over de structuur, terwijl de half ontwikkelde formule ons al laat visualiseren hoe deze structuur eruit ziet..
Merk ook op dat de C-H-bindingen zijn weggelaten, waardoor alleen de C-C-bindingen worden benadrukt die de koolstofketen of het skelet vormen. Het zal duidelijk zijn dat voor eenvoudige moleculen de ontwikkelde formule samenvalt met de gecondenseerde formule; en zelfs met het moleculaire.
Artikel index
- 1 Voorbeelden
- 1.1 Methaan
- 1.2 Propaan
- 1.3 Butaan
- 1.4 Pentaan
- 1.5 Ethanol
- 1.6 Dimethylether
- 1.7 Cyclohexaan
- 1.8 Fosforzuur
- 2 Algemene opmerking
- 3 referenties
Voorbeelden
Methaan
De molecuulformule van methaan is CH4, omdat het vier C-H-bindingen heeft en een tetraëdrische geometrie heeft. Deze gegevens worden geleverd door de structuurformule met wiggen buiten of onder het vlak. Voor methaan wordt de gecondenseerde formule ook CH4, evenals de empirische en semi-ontwikkelde. Dit is de enige verbinding waarvoor dit unieke karakter wordt vervuld..
De reden dat de semi-ontwikkelde formule voor methaan CH is4, het is omdat hun C-H-bindingen niet zijn geschreven; dat zou overeenkomen met de structuurformule.
Propaan
De semi-ontwikkelde formule voor propaan is CH3-CHtwee-CH3, met slechts twee CC-bindingen. Het molecuul is lineair, en als je het opmerkt, is de gecondenseerde formule precies hetzelfde: CH3CHtweeCH3, het enige verschil is dat de C-C-bindingen zijn weggelaten. Voor propaan is het waar dat zowel de halfontwikkelde als de gecondenseerde formule samenvallen.
Dit geldt in feite voor alle alkanen met een lineaire keten, zoals in de volgende paragrafen zal worden gezien.
Butaan
De half ontwikkelde formule van butaan is CH3-CHtwee-CHtwee-CH3. Merk op dat het op dezelfde regel kan worden geschreven. Deze formule komt strikt genomen overeen met die van de n-butaan, wat aangeeft dat het het lineaire en onvertakte isomeer is. Het vertakte isomeer, 2-methylpropaan, heeft de volgende semi-ontwikkelde formule:
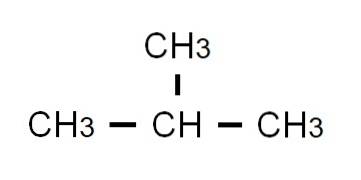
Deze keer kan het niet meer op dezelfde regel worden geschreven of weergegeven. Deze twee isomeren hebben dezelfde molecuulformule: C4H.10, die niet dienen om elkaar van elkaar te onderscheiden.
Pentaan
We hebben weer een ander alkaan: pentaan, waarvan de molecuulformule C is5H.12. De semi-ontwikkelde formule van n-pentaan is CH3-CHtwee-CHtwee-CHtwee-CH3, gemakkelijk te representeren en te interpreteren, zonder de noodzaak om de C-H links te plaatsen. CH-groepen3 heten methyl of methyls, en CHtwee zijn de methylenen.
Pentaan heeft andere vertakte structurele isomeren, die te zien zijn in de onderste afbeelding die wordt weergegeven door hun respectieve halfontwikkelde formules:
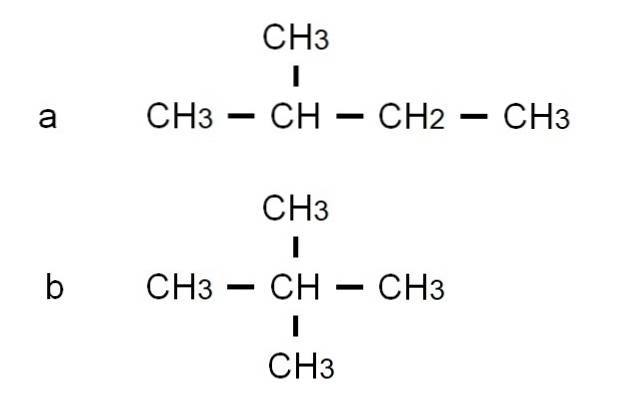
De isomeer naar is 2-methylbutaan, ook wel isopentaan genoemd. Ondertussen de isomeer b is 2,2-dimethylpropaan, ook wel neopentaan genoemd. De semi-ontwikkelde formules maken het verschil tussen de twee isomeren duidelijk; Maar het zegt niet veel over hoe zulke moleculen eruit zouden zien in de ruimte. Hiervoor zijn structurele formules en modellen nodig.
Ethanol
Halfontwikkelde formules worden niet alleen gebruikt voor alkanen, alkenen of alkynen, maar voor elk type organische verbinding. Aldus heeft ethanol, een alcohol, de halfontwikkelde formule: CH3-CHtwee-OH. Merk op dat nu een C-O-binding wordt weergegeven, maar niet de O-H-binding. Alle waterstofbruggen worden verwaarloosd.
Lineaire alcoholen zijn gemakkelijk weer te geven, evenals alkanen. Kortom: alle semi-ontwikkelde formules voor lineaire moleculen zijn eenvoudig te schrijven.
Dimethylether
Ethers kunnen ook worden weergegeven met semi-ontwikkelde formules. In het geval van dimethylether, waarvan de molecuulformule C istweeH.6Of, de halfontwikkelde wordt: CH3-O-CH3. Merk op dat dimethylether en ethanol structurele isomeren zijn, omdat ze dezelfde moleculaire formule delen (tel de C-, H- en O-atomen).
Cyclohexaan
Halfontwikkelde formules voor vertakte verbindingen zijn vervelend om weer te geven dan lineaire; maar meer nog zijn cyclische verbindingen, zoals cyclohexaan. Zijn moleculaire formule komt overeen met dezelfde als voor hexeen en zijn structurele isomeren: C6H.12, aangezien de hexagonale ring als onverzadiging telt.
Om cyclohexaan weer te geven, wordt een zeshoekige ring getekend op de hoekpunten waarvan de methyleengroepen zich zullen bevinden, CHtwee, net zoals hieronder te zien:
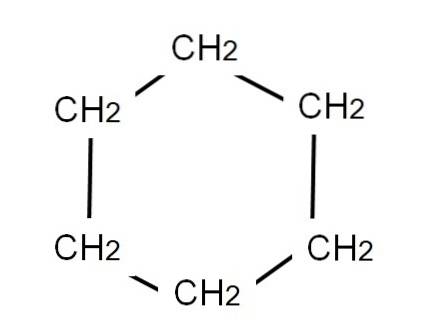
De ontwikkelde formule van cyclohexaan zou de CH-bindingen laten zien, alsof de ring televisie-'antennes 'had.
Fosforig zuur
De molecuulformule van fosforzuur is H3PO3. Voor veel anorganische verbindingen is de molecuulformule voldoende om u een idee te geven van de structuur. Maar er zijn verschillende uitzonderingen, en dit is er een van. Met het feit dat de H3PO3 is een diprotisch zuur, de half ontwikkelde formule is: HPO (OH)twee.
Dat wil zeggen, een van de waterstofatomen is direct gebonden aan het fosforatoom. De formule H3PO3 laat ook een molecuul toe met een semi-ontwikkelde formule: PO (OH)3. Beide zijn in feite wat bekend staat als tautomeren.
Halfontwikkelde formules in de anorganische chemie lijken sterk op gecondenseerde formules in de organische chemie. In anorganische verbindingen, omdat ze geen C-H-bindingen hebben en omdat ze in principe eenvoudiger zijn, zijn hun moleculaire formules meestal voldoende om ze te beschrijven (als het covalente verbindingen zijn).
Algemene opmerking
Halfontwikkelde formules zijn heel gebruikelijk wanneer de student de regels van de nomenclatuur leert. Maar eenmaal geassimileerd, zijn scheikundige aantekeningen over het algemeen volgepropt met skeletachtige structuurformules; dat wil zeggen dat niet alleen de C-H links worden weggelaten, maar er wordt ook tijd bespaard door de C te negeren.
Voor de rest zijn gecondenseerde formules meer terugkerend in de organische chemie dan halfontwikkelde formules, aangezien de eerste de links niet eens hoeven te schrijven zoals in de laatste. En als het om anorganische chemie gaat, worden deze semi-ontwikkelde formules minder vaak gebruikt..
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2020). Half ontwikkelde formule. Hersteld van: es.wikipedia.org
- Siyavula. (s.f.). Organische moleculaire structuren. Hersteld van: siyavula.com
- Jean Kim en Kristina Bonnett. (05 juni 2019). Organische structuren tekenen. Chemie Libretexts. Hersteld van: chem.libretexts.org
- Leraren. MARL en JLA. (s.f.). Inleiding tot koolstofverbindingen. [Pdf]. Hersteld van: ipn.mx


Niemand heeft nog op dit artikel gereageerd.